
【题目】工业上用净化后的水煤气在催化剂作用下,与水蒸气发生反应制取氢气,化学方程式为CO(g)+H2O(g) ![]() H2(g)+CO2(g)。一定条件下,将4 mol CO与2 mol H2O(g)充入体积为2 L的密闭容器中,体系中各物质的浓度随时间的变化如图所示:
H2(g)+CO2(g)。一定条件下,将4 mol CO与2 mol H2O(g)充入体积为2 L的密闭容器中,体系中各物质的浓度随时间的变化如图所示:
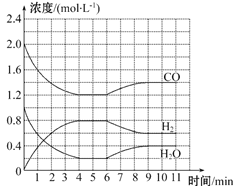
(1)在0~4 min时段,反应速率v(H2O)为_______mol·L-1·min-1,该条件下反应的平衡常数K为______(保留两位有效数字)。
(2)该反应到4 min时,CO的转化率为________。
(3)若6 min时改变的外部条件为升温,则该反应的ΔH________0(填“>”“=”或“<”),此时反应的平衡常数________(填“增大”“减小”或“不变”)。
(4)判断该反应达到化学平衡状态的依据是________。
a.混合气体的密度不变 b.混合气体中c(CO)不变
c.v(H2O)正=v(H2)逆 d.断裂2 mol H—O键的同时生成1 mol H—H键
(5)若保持与4 min时相同的温度,向一容积可变的密闭容器中同时充入0.5 mol CO、1.5 mol H2O(g)、0.5 mol CO2和a mol H2,则当a=2.5时,上述反应向________(填“正反应”或“逆反应”)方向进行。若要使上述反应开始时向逆反应方向进行,则a的取值范围为___________________________。
【答案】 0.2 2.7 40% < 减小 bc 正反应 a>4.05
【解析】(1)图象分析可知4min反应达到平衡状态,物质浓度为c(CO)=1.2mol/L,c(H2)=0.8mol/L,c(H2O)=0.2mol/L,则
CO(g)+H2O(g) ![]() H2(g)+CO2(g)
H2(g)+CO2(g)
起始浓度(mol/L) 2 1 0 0
变化浓度(mol/L) 0.8 0.8 0.8 0.8
平衡浓度(mol/L) 1.2 0.2 0.8 0.8
在0~4min时段,反应速率v(H2O)=0.8mol/L÷4min=0.2mol/(Lmin),平衡常数K=0.8×0.8/1.2×0.2=2.7;
(2)该反应到4min时,CO的转化率=0.8/2×100%=40%;
(3)若6min时改变的外部条件为升温,图象可知氢气浓度减小,一氧化碳和水的浓度增大,说明平衡逆向进行,逆向为吸热反应,正反应为放热反应,则该反应的△H<0,此时平衡逆向进行,平衡常数减小;
(4)根据上述分析可知反应是气体体积不变的放热反应,则a.反应前后气体质量和体积不变,混合气体的密度始终不变,不能说明反应达到平衡状态,a错误;b.混合气体中c(CO)不变是平衡的标志,b正确;c.v(H2O)正=v(H2)逆,表示正逆反应速率相等,能证明反应达到平衡状态,c正确;d.断裂2molH-O键的同时生成1molH-H键,反应均是正向进行,不能说明正逆反应速率相同,d错误;答案选bc;
(5)若保持与4min时相同的温度,向一容积可变的密闭容器中同时充入0.5molCO、1.5molH2O(g)、0.5molCO2和amolH2,则当a=2.5时,浓度熵Q=2.5×0.5/0.5×1.5=1.7<K=2.7,说明反应正向进行;若要使上述反应开始时向逆反应进行,Q=a×0.5/0.5×1.5>2.7,则a的取值范围为a>4.05。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G(分子式为C13H18O2)是一种香料,下图是该香料的一种合成路线。
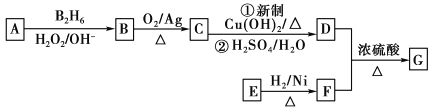
已知:
①E能够发生银镜反应,1 mol E能够与2 mol H2完全反应生成F
②R—CH=CH2![]() R—CH2CH2OH
R—CH2CH2OH
③有机物D的摩尔质量为88 g·mol-1,其核磁共振氢谱有3组峰
④有机物F是苯甲醇的同系物,苯环上只有一个无支链的侧链
回答下列问题:
(1)用系统命名法命名有机物B:__________。
(2)E的结构简式为__________。
(3)C与新制Cu(OH)2反应的化学方程式为______________________________________________。
(4)有机物C可与银氨溶液反应,配制银氨溶液的实验操作为__________________
(5)已知有机物甲符合下列条件:①为芳香族化合物②与F互为同分异构体③能被催化氧化成醛。
符合上述条件的有机物甲有_________种。其中满足苯环上有3个侧链,且核磁共振氢谱有5组峰,峰面积之比为6∶2∶2∶1∶1的有机物的结构简式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.萃取分液法 B.加热分解 C.结晶法 D.分液法 E.渗析法 F.蒸馏法 G.过滤法
(1)___________分离水和煤油的混合物。
(2)___________分离水和酒精。
(3)___________分离溴水中的溴和水。
Ⅱ、欲用98%的浓硫酸(g=1.84g/cm3)配制浓度为0.5mol/L的稀硫酸480ml。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平⑦药匙。
请回答下列问题:
(4)上述仪器中,在配制稀H2SO4时不需要使用的有___________(填代号),还缺少的仪器是______________________;
(5)经计算,需浓H2SO4的体积为___________;如果实验室有15mL、20mL、50mL的量筒应选用_______mL的量筒最好,量取时俯视量筒读数将使浓度__________(“偏高”、“偏低”、“无影响”);
(6)将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌的目的是____________,若未冷却至室温便将溶液转移至容量瓶会使浓度偏________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
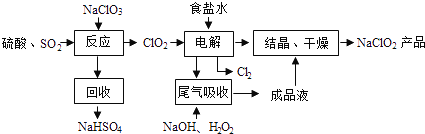
回答下列问题:
(1)NaClO2中Cl的化合价为__________价。
(2)写出“反应”步骤中生成ClO2的化学方程式___________________。
(3)“电解”中阴极反应的主要产物是_________________。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2,此吸收反应中,氧化剂与还原剂的物质的量之比为_________, 该反应中氧化产物是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于钠元素的单质及其化合物的叙述不正确的是( )
A. 钠是银白色金属,质软,熔点相对较低,密度比水小
B. Na2O2中阴阳离子个数比为1∶1
C. 金属钠在空气中长期放置,最终变为碳酸钠
D. Na2O和Na2O2都能由金属钠和氧气化合生成,但Na2O和Na2O2中O的价态不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法正确的组合是 ( )
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如图所示),已知Ca2+、O2—、Ti4+分别位于立方体的体心、面心和顶点,则每个Ti4+和12个O2—相紧邻

⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②③⑥ B.①②④ C.③⑤⑦ D.③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两物质作用时,如果反应条件或反应物用量改变,对生成物没有影响的是( )
A.Na与O2B.Na2O2与CO2C.Fe与O2D.AlCl3溶液与NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】做焰色反应实验用的铂丝,每试验一种样品后都必须进行的操作是( )
A. 用水洗涤2~3次后再使用
B. 用盐酸洗涤后,再在酒精灯火焰上灼烧到没有颜色,才可使用
C. 用滤纸擦干后才可使用
D. 用盐酸洗涤后,经蒸馏水冲洗,方可使用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com