
【题目】下列化学用语正确的是( )
A.甲烷的电子式: 
B.氟原子的结构示意图: ![]()
C.乙烯的结构简式:CH2CH2
D.碳酸钠的电离方程式:Na2CO3=Na2++CO32﹣
科目:高中化学 来源: 题型:
【题目】在一定温度下,将冰醋酸加水稀释的过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.
请回答下列问题:
(1)“O”点冰醋酸不能导电的原因是 .
(2)a、b、c三点对应的溶液中,C(H+)由小到大的顺序为 . (填字母,后同)
(3)a、b、c三点对应的溶液中,CH3COOH的电离程度最大的是 .
(4)a、b、c三点对应的溶液中,水的电离程度最大的是 .
(5)若使c点对应的溶液中的c(CH3COO﹣)增大,在下列措施中,可行的是 (填字母,后同).
A.加热
B.加KOH固体
C.加水
D.加CH3COONa固体
E.加锌粒
(6)在稀释过程中,随着醋酸浓度的降低,下列各量始终保持增大趋势的是 .
A.C(H+)
B.H+物质的量
C.C(OH﹣)
D.![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素位于短周期,原子序数依次增大,C基态原子核外有三个未成对电子,B与D形成的化合物BD与C的单质C2电子总数相等,CA3分子结构为三角锥形,D与E可形成E2D与E2D2两种离子化合物,D与F是同族元素.
根据以上信息,回答下列有关问题:
(1)写出基态时D的电子排布图 .
(2)写出化合物E2F2的电子式 , 化合物ABC的结构式 .
(3)根据题目要求完成以下填空:
BF32﹣中心原子杂化方式;D3中心原子杂化方式;
FD42﹣微粒中的键角;FD3分子的立体构型 .
(4)根据等电子原理,指出与BD2互为等电子体且含有C原子的微粒有、(要求写一种分子和一种离子).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学进行如下实验,以探究化学反应中的能量变化。
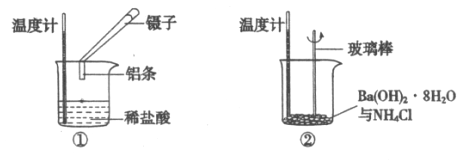
(1)实验表明:②中的温度降低,由此判断氢氧化钡晶体与氯化铵晶体反应是____________(填“吸热”或“放热”)反应。
(2)实验①中,该小组同学在烧杯中加入5 mL 1.0 mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图A所示,该反应是________(填“吸热”或“放热”)反应,其能量变化可用下图中的___________(填“B”或“C”)表示。

A中0—t1段化学反应速率变化的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列比较中正确的是( )
A.离子还原性:S2->Cl->Br->I-
B.氧化性:F2>Cl2>Br2>S
C.酸性:H2SO4>HClO4>H3PO4
D.非金属性:F>Cl>S>O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的某溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如图:下列有关推断不正确的是( )
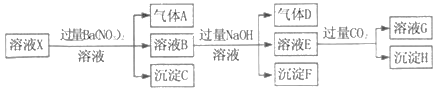
A. 溶液X中一定含有H+、Al3+、NH4+、Fe2+、SO42﹣
B. 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl﹣
C. 沉淀H为Al(OH)3、BaCO3的混合物
D. 若溶液X为100mL,产生的气体A为44.8mL(标准状况),则X中c(Fe2+)=0.06molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为TS(中文名![]() ,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
A. TS是第七周期第ⅦA族元素 B. TS的同位素原子具有相同的电子数
C. TS在同族元素中非金属性最弱 D. 中子数为176的TS核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传统的冰箱制冷剂“氟利昂”( CCl2F2)泄漏后台破坏臭氧层.其反应过程可表示为:O3﹣→O+O2;Cl+O3→ClO+O2;ClO+O→Cl+O2 , 总反应为2O3→3O2 . 则上述臭氧变成氧气的反应过程中,Cl原子的作用是( )
A.氧化剂
B.还原剂
C.催化剂
D.稳定剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个体积为1 L的密闭容器中发生某化学反应:2A(g) ![]() B(g)+C(g),三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800° C,实验Ⅲ在950°C。B、C的起始浓度都为0,反应物A的浓度(mol L-1)随时间(min)的变化如图所示。试回答下列问题:
B(g)+C(g),三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800° C,实验Ⅲ在950°C。B、C的起始浓度都为0,反应物A的浓度(mol L-1)随时间(min)的变化如图所示。试回答下列问题: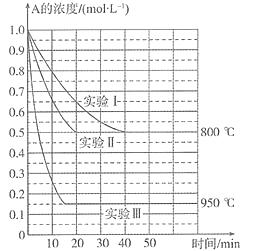
(1)在实验Ⅰ中,反应在2040 min内A的平均反应速率为mol L-1min-1。实验Ⅱ和实验Ⅰ相比,可能隐含的反应条件是。
(2)该反应的ΔH0,其判断理由是。
(3)实验Ⅰ第40 min末,若降低反应温度,达到新的平衡后,A的浓度不可能为________(填序号)。
A.0.35 mol·L1
B.0.4 mol·L1
C.0.7 mol·L1
D.0.8 mol·L1
(4)若反应在800°C进行,在该1 L的密闭容器中加入1 mol A、0.2 mol He,达到平衡时A的转化率应____________。
A.等于86%
B.等于50%
C.小于50%
D.在50%86%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com