
【题目】甲、乙、丙均为化合物,其中甲为淡黄色的固体,乙常温下为无色无味液体,丙为常见的无色无味气体,它们有如下图的转化关系,已知D为黄绿色气体,按要求回答下列问题:

(1)甲物质为____________(填化学式)。
(2)乙与甲反应的化学方程式为____________,丙与甲反应的化学方程式为____________。
(3)D能使湿润的有色布条褪色,其褪色原因是____________(结合化学反应方程式描述原因)。
(4)D可用于制取“84”消毒液,反应的化学方程式为____________,也可用于工业上制取漂白粉,反应的化学方程式为____________,但漂白粉保存不当易变质,变质时涉及到的化学方程式为____________。
【答案】Na2O2 2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2 Cl2+H2O=HCl+HClO、 HClO有漂白性 Cl2+2NaOH=NaClO+NaCl+H2O 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO,2HClO![]() 2HCl+O2↑
2HCl+O2↑
【解析】
甲、乙、丙均为化合物,甲为淡黄色的固体,乙常温下为无色无味液体,丙为常见的无色无味气体,甲能既能与乙反应也能与丙反应,可知甲为Na2O2,乙为H2O,丙为CO2,则A为NaOH,B为O2,C为Na2CO3,D为黄绿色气体,则D为Cl2,D(Cl2)与A(NaOH)反应生成NaCl、NaClO,F的溶液能与丙(CO2)反应C与I,则F为NaClO、E为NaCl、I为HClO,G与C(Na2CO3)反应得到E(NaCl)与丙(CO2),则G为HCl,据此解答。
根据上述分析可知:甲为Na2O2,乙为H2O,丙为CO2,A为NaOH,B为O2,C为Na2CO3,D为Cl2,E为NaCl,F为NaClO,G为HCl,I为HClO。
(1)甲是过氧化钠,化学式为Na2O2;
(2)甲为Na2O2,乙为H2O,丙为CO2,Na2O2与H2O反应产生NaOH和O2,反应方程式为:2Na2O2+2H2O=4NaOH+O2↑;Na2O2与CO2反应产生Na2CO3和O2,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2;
(3)D为Cl2,氯气与水反应产生HCl和HClO,反应方程式为:Cl2+H2O=HCl+HClO ,产生的HClO由于有强氧化性而具有漂白性,能够将有色物质氧化变为无色,所以氯气能够使湿润的有色布条褪色;
(4)Cl2与NaOH溶液发生反应:Cl2+2NaOH=NaCl+NaClO+H2O,得到的溶液为NaCl、NaClO的混合物,即为“84”消毒液,有效成分为NaClO;氯气与石灰乳发生反应制取漂白粉,反应为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,有效成分为Ca(ClO)2,由于酸性H2CO3>HClO,所以漂白粉在空中中露置,会发生反应:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO,产生的HClO不稳定,光照易分解:2HClO![]() 2HCl+O2↑,导致漂白粉失效,所以漂白粉要密封保存在冷暗处。
2HCl+O2↑,导致漂白粉失效,所以漂白粉要密封保存在冷暗处。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】第二代复合火箭推进剂发生的反应可表示为:①2NH4ClO4→N2↑+Cl2↑+2O2↑+4H2O;②4Al(s)+3O2(g)→2Al2O3(s)+QkJ(Q>0)。完成下列填空:
(1)书写H2O的电子式____________________,Cl原子核外有______种不同能量的电子。
(2)上述物质所形成的晶体中,只包含一种微粒间作用力的是________(填序号)。
a. N2 b. Al2O3 c. H2O d. NH4ClO4
(3)N2和O2都能与H2反应,但二者反应条件差异较大,分析可能原因:①从分子断键角度看,N2分子更难断键,原因是_________________________________;②从原子成键角度看,O原子更易与H原子结合,原因是______________________________________________。
(4)反应①中,氧化产物是_______;生成1molN2时,反应中转移_______NA电子。铵盐都易分解,NH4Cl、NH4HCO4等受热分解得到NH3和相应的酸,而NH4NO3等铵盐和NH4ClO4分解相似,一般无法得到对应酸,且产物可能为N2或NO等物质。请分析不同铵盐受热分解产物存在差异的可能原因:__________。
(5)下列能量变化示意图可与反应②中所体现的能量关系匹配的是________(填序号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素。下列判断正确的是( )

A.金属性:甲>乙>丁
B.原子半径:辛>己>戊
C.丙与庚的原子核外电子数相差13
D.乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年为门捷列夫发现元素周期律150周年。门捷列夫预言了很多未知元素,锗是其中一种,工业上用精硫锗矿(主要成分为GeS2)制取高纯度锗,其工艺流程如图所示。请回答:
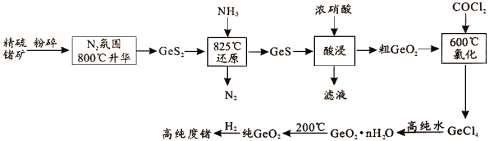
(1)锗在元素周期表中的位置是__________。
(2)800℃,在N2氛围中使精硫锗矿升华的目的是______________。
(3)酸浸时Ge、S元素均被氧化到最高价态,写出该反应的离子方程式____。酸浸时温度不能过高的原因是_____
(4)GeCl4易水解生成GeO2·nH2O,此过程化学方程式为_____。温度对GeCl4水解率的影响如图所示,为提高水解率,实验时可采取的措施为______(填序号)。

A.冰水浴
B.冰盐水浴
C.49℃水浴
(5)请判断25℃时0.1mol·L-1NaHGeO3溶液pH________(填“>”=”或“<”)7,理由是____(已知25℃时,H2GeO3的Ka1=1.7×10-9,Ka2=1.9×10-13)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某金属氯化物MCl2 28.5 g,含有0.6 mol Cl-,则该氯化物的摩尔质量为____________,金属M的名称为____________。
(2)11.1 g CaCl2所含氯离子数与标准状况下约__________L O3所含氧原子数相等。(计算结果保留一位小数点)
(3)若a g SO2含b个原子,则阿伏加德罗常数为__________(用含a、b的公式表示)。
(4)某气体在标准状况下的密度为1.25 g/L,则 28 g该气体所含有的分子数为____________。
(5)与3.6 g水含有相同氧原子数目的硫酸的质量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知难溶性物质K2SO4·MgSO4·2CaSO4在水中存在如下平衡: K2SO4·MgSO4·2CaSO4(s)![]() 2Ca2+(aq)+2K+(aq)+Mg2+(aq)+4SO42- (aq),不同温度下,K+的浸出浓度与溶浸时间的关系如图所示。则下列说法错误的是
2Ca2+(aq)+2K+(aq)+Mg2+(aq)+4SO42- (aq),不同温度下,K+的浸出浓度与溶浸时间的关系如图所示。则下列说法错误的是

A. 向该体系中分别加入饱和NaOH溶液和饱和碳酸钠溶液,沉淀溶解平衡均向右移动
B. 分析可知T1>T2>T3
C. 升高温度,溶浸速率增大,平衡向右移动
D. 该物质的Ksp=c2(Ca2+)·c2(K+)·c(Mg2+)·c4(SO42-)/c(K2SO4·MgSO4·2CaSO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的 A 置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:A(s)![]() 2B(g)+C(g)+D(g)。不能判断该分解 反应已经达到化学平衡状态的是
2B(g)+C(g)+D(g)。不能判断该分解 反应已经达到化学平衡状态的是
A.v 正(B)=2v 逆(C)B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变D.密闭容器中气体 B 的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表述正确的是
A. 钢铁吸氧腐蚀中的正极反应:4OH--4e-=2H2O +O2
B. 由Na和Cl形成离子键的过程:![]()
C. NaHCO3的水解平衡:HCO3-+H2O ![]() H3O++CO32-
H3O++CO32-
D. 实验室制乙炔的反应:CaC2+H2O →CaO+C2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在银锌原电池中,以硫酸铜为电解质溶液,锌为_____极,电极上发生的是_____反应(“氧化”或“还原”).电极反应式为_____,锌片上观察到的现象为_____银为_____极,电极上发生的是_____反应(“氧化”或“还原”),电极反应式是_____,银片上观察到的现象是_____.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com