
| A. | pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| B. | 在0.1 mol•L-1 NaHS溶液中:c(H+)=c(S2-)+c(OH-)+c(HS-) | |
| C. | 将0.1 mol•L-1 Na2CO3溶液和0.2 mol•L-1 NaHCO3溶液等体积混合:3c(Na+)=4c(CO32-)+4c(HCO3-) | |
| D. | 向0.1 mol•L-1 NaHSO4溶液中滴加氨水至溶液恰好呈中性:c(Na+)=c(NH4+)=c(SO42-)>c(OH-)=c(H+) |
分析 A.溶液中存在电荷守恒分析;
B.NaHS溶液中存在电荷守恒分析;
C.将0.1 mol•L-1 Na2CO3溶液和0.2 mol•L-1 NaHCO3溶液等体积混合溶液中存在物料守恒,3n(Na)=4n(C);D.依据电荷守恒和物料守恒分析判断;
解答 解:A.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),故A正确;
B.在0.1 mol•L-1 NaHS溶液中电荷守恒:c(Na+)+c(H+)=2c(S2-)+c(OH-)+c(HS-),c(Na+)≠c(S2-),故B错误;
C.将0.1 mol•L-1 Na2CO3溶液和0.2 mol•L-1 NaHCO3溶液等体积混合溶液中存在物料守恒,3n(Na)=4n(C),3c(Na+)=4c(CO32-)+4c(HCO3-)+4c(H2CO3),故C错误;
D.向0.1 mol•L-1 NaHSO4溶液中滴加氨水至溶液恰好呈中性,c(OH-)=c(H+),c(Na+)+c(NH4+)+c(H+)=2c(SO42-)+c(OH-),c(Na+)+c(NH4+)=2c(SO42-),物料守恒c(Na+)=c(SO42-),得到c(NH4+)=c(SO42-),则c(Na+)=c(NH4+)=c(SO42-)>c(OH-)=c(H+),故D正确;
故选AD.
点评 本题考查了离子浓度大小比较,电解质溶液中电荷守恒、物料守恒的分析应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
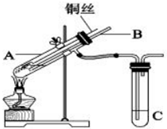 (1)用铜与浓硫酸反应制取硫酸铜,实验装置如图所示.
(1)用铜与浓硫酸反应制取硫酸铜,实验装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
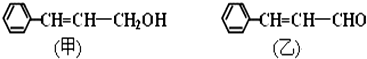
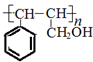 .
.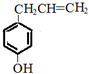 .
.
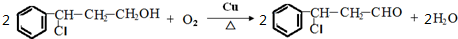 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
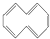 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 根据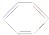 的结构特点可知环癸五烯的分子式为C10H8 的结构特点可知环癸五烯的分子式为C10H8 | |
| B. | 常温常压下环癸五烯是一种易溶于水的无色气体 | |
| C. | 环癸五烯既能使溴水褪色,又能使酸性KMnO4溶液褪色 | |
| D. | 环癸五烯与Cl2的加成产物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| B. | NaHCO3溶液中加入足量的Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 钠和水反应:Na+H2O═Na++OH-+H2↑ | |
| D. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
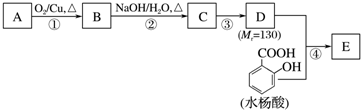
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释 |
| A | N原子的第一电离能小于O原子 | 同周期元素原子的电离能随原子序数增大而增大 |
| B | CO2为直线形分子 | CO2分子中C为sp杂化,键角为180° |
| C | 金刚石的熔点高于石墨 | 金刚石是原子晶体,石墨是分子晶体 |
| D | HF的沸点低于HCl | HF的相对分子质量小于HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com