
����Ŀ��K4[Fe(CN)6]�������������ᡢҩ��ȡ�
(1)Fe2+�ĺ�������Ų�ʽΪ_____��
(2)CN����Cԭ�ӹ�����ӻ�����Ϊ_____����CN����Ϊ�ȵ������һ�ַ��ӵĽṹʽΪ_____��
(3)[Cu(H2O)4]2+�ṹʾ��ͼ��ͼ��ʾ��[Fe(CN)6]4���ṹʾ��ͼ��ͼ��ʾ������ͼ����Ӧλ�ò�������_________��

(4)��֪3K4Fe(CN)6![]() 12KCN+Fe3C+3C+(CN)2��+2N2����(CN)2��������������������Ŀ��n(��)��n(��)��_____��
12KCN+Fe3C+3C+(CN)2��+2N2����(CN)2��������������������Ŀ��n(��)��n(��)��_____��
(5)����ý�Ǻϳɰ���Ӧ�Ĵ������������ڵ�ԭ�ӡ���ԭ�����������ϵĵ��㸽�žֲ�ʾ����ͼ��ʾ�����������ϵ�ԭ������ԭ�ӵ���Ŀ��Ϊ_____��

���𰸡�[Ar]3d6��1s22s22p63s23p63d6 sp N��N��C��O  3��4 1��2
3��4 1��2
��������
��1����������ԭ������ع�����д���������Ų�ʽ��
��2������ԭ�ӵ��ӻ������ж����ӻ����ͣ��ٽ�ϵȵ�����ԭ�������ҳ���ȵ����壻
��3��������������ۣ��������ṩ�µ��ӶԵ�ԭ��ΪC�����[Cu(H2O)4]2���ṹʾ��ͼ���ɣ�
��4������C��Nԭ������8�����ȶ��ṹ����ȷ��д��ṹʽ�����ݹ��ۼ������ҵ���������������������Ŀ��
��5���þ�����ÿ��Nԭ����Χ��4��Feԭ�ӡ�ÿ��Feԭ����Χ��2��Nԭ�ӣ����þ�̯������������������Fe��Nԭ�����ı�ֵ��
��1��Fe��ԭ������Ϊ26��Fe2���ĺ��������Ϊ24��Fe2���ĺ�������Ų�ʽΪ[Ar]3d6��1s22s22p63s23p63d6��
�ʴ�Ϊ��[Ar]3d6��1s22s22p63s23p63d6��
��2��CN�����ӻ������Ϊ2��δ�ӻ���2��p����γ�2���������������sp�ӻ���ʽ��N2��CO������CN-��ԭ������Ϊ2���۲��������Ϊ10����Ϊ�ȵ����壬����CN����Ϊ�ȵ������һ�ַ��ӵĽṹʽΪN��N��C��O��
�ʴ�Ϊ��sp��N��N��C��O��
��3��[Fe(CN)6]4������λ��Ϊ6����ͼ�п��Կ����������е�Cԭ���ṩ�¶Ե�������������Fe2+�γ���λ��������ṹʾ��ͼ�ɱ�ʾΪ�� ��
��
�ʴ�Ϊ�� ��
��
��4��(CN)2���ӵĽṹʽΪN��C-C��N������һ�����۵���Ϊһ��������һ����������Ϊһ��������2��������֪����÷����ڷ�����������3����������4������CN)2��������������������Ŀ��n(��)��n(��)��3��4��
�ʴ�Ϊ��3��4��
��5���þ�����ÿ��Nԭ����Χ��4��Feԭ�ӡ�ÿ��Feԭ����Χ��2��Nԭ�ӣ����þ�̯��֪���������ϵ�ԭ������ԭ�ӵ���Ŀ��Ϊ=![]() ��
��![]() = 1��2��
= 1��2��
�ʴ�Ϊ��1��2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��C2H4��C2H2�Ⱦ������ʵ��������β���Kolbe��ⷨ�õ�����ͼΪ��ȡC2H2�ĵ��װ�ã���װ�ù���ʱ������˵���д������

A. ����ת��Ϊ��ѧ��
B. ������Χ��Һ��pH��������
C. �缫a�Ϸ�����![]()
D. ��ȡ��ϩ����CH3COOK��Һ���������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����㣺
��1����14.2g��ˮ���������Ƴ�500mL��Һ�������ʵ���Ũ��Ϊ____mol��L-1��
��2��������ȡ��50mL�������ʵ���Ũ��Ϊ____mol��L-1�����ʵ�����Ϊ___g��
��3��������50mL��Һ��ˮϡ�͵�100mL��������Һ��Na+�����ʵ���Ũ��Ϊ____mol��L-1��SO42-�����ʵ���Ũ��Ϊ_____mol��L-1��
��4����֪��a gij����A����b�����ӣ���c g�������ڱ�״���µ����Ϊ____ L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��пƬ��һ��ͭƬƽ�еز���ʢ��ϡ������Һ���ձ��У��۲쵽��������________�����õ��߰�пƬ��ͭƬ�����������ڵ����м�������������ƣ������������Ϲ۲쵽��������________����ԭ����е��������ķ�����________���ܷ�Ӧ�Ļ�ѧ����ʽ��________������________Ԫ�ر�������________���Ϸ�����ԭ��Ӧ����������ѧ����ʽ�Ϸ��õ����ű������ת�Ƶķ������Ŀ��___________
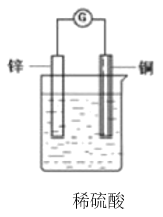
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�й����İ���(NH3��NH4+)�ᵼ��ˮ�帻Ӫ������ij����С����NaClO����������������ˮ����֪����HClO�������Ա�NaClOǿ����NH3��NH4+���ױ��������۹��ұ�Ҫ�������İ�����ˮpHҪ������6��9��
(1)pH��1.25ʱ��NaClO����NH4+��Ӧ����N2������Ⱦ���ʣ��÷�Ӧ�����ӷ���ʽΪ_____��
(2)��ˮpH����ȥ���ʺͳ�ˮpH��Ӱ������ͼ��ʾ

�ٽ�ˮpHΪ1.25��2.75��Χ�ڣ�����ȥ������pH����Ѹ���½���ԭ����_____
�ڽ�ˮpHΪ2.75��6.00��Χ�ڣ�����ȥ������pH���߶�������ԭ����_____
�۽�ˮpHӦ������_____����Ϊ�ˡ�
(3)Ϊ�о�������NaClO����������Ӱ�죬�����������䣬�����ӵ�λʱ����ͨ��������������ְ���ȥ���ʼ������䡣��ԭ�������_____(����ĸ)��
a��O2�������Ա�NaClO�� b��O2�����������ʱ�NaClO��
c��O2����Һ���ܽ�ȱȽ�С d�������е�N2������Һ��
(4)��������ȼ�ϵ�ؿ��Զ�����ˮ���д�������װ����ͼ��ʾ���պϵ�·�������������Ҿ�����������������NH4+������Ӧ�ĵ缫��ӦʽΪ_____����װ�ó����ܶ�����ˮ���д����⣬��һ��ͻ�����ŵ���_____��
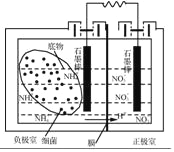
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���Ϊ�������л�������Ʒ�ͻ�������ȼ�Ͼ��й�����Ӧ��ǰ����CO2����ϳɼ״��Ǻ�������CO2����Ч;������CO2�Ʊ��״����̿����漰��Ӧ���£�
��Ӧ��CO2(g)��H2(g) ![]() CO(g)��H2O(g) ��H1����41.19 kJ��mol��1
CO(g)��H2O(g) ��H1����41.19 kJ��mol��1
��Ӧ��CO(g)��2H2(g) ![]() CH3OH(g) ��H2
CH3OH(g) ��H2
��Ӧ��CO2(g)��3H2g) ![]() CH3OH(g)��H2O(g) ��H3����49.58 kJ��mol��1
CH3OH(g)��H2O(g) ��H3����49.58 kJ��mol��1
�ش��������⣺
��1����Ӧ��Ļ�ѧƽ�ⳣ���ֱ�ΪK1��K2��K3����K3=__________����K�Ĵ���ʽ��ʾ��
��2���ں�ѹ�ܱ������У�����һ������ H2 �� CO2���ٶ���������Ӧ��ʵ���÷�Ӧ���ڲ�ͬ�¶��£���Ӧ��ϵ�� CO2 ��ƽ��ת������ѹǿ�Ĺ�ϵ������ͼ 1 ��ʾ��

�ٱȽ� T1 �� T2 �Ĵ�С��ϵ��T1____________T2���������������������
���� T1 �� p6 �������£����ܱ������г��� 3 mol H2 �� 1 mol CO2���÷�Ӧ�ڵ� 5 min ʱ�ﵽƽ�⣬��ʱ���������Ϊ 1.8 L����÷�Ӧ�ڴ��¶��µ�ƽ�ⳣ��Ϊ________��
a.���������·�Ӧ�� 3 min ʱ�̣��ı��������� A �㴦�ﵽƽ�⣬CH3OH ��Ũ���淴Ӧʱ��ı仯������ͼ 2��ʾ��3��4 min ��Ũ�ȱ仯δ��ʾ����������ı������Ϊ __________������ H2 ��Ũ�ȱ仯�����4 min��ʼ�� A��ķ�Ӧ����v(H2)= _________(������λС��)��
b.���¶Ȳ��䣬ѹǿ�㶨�� p8 �����������´ﵽƽ��ʱ�������������Ϊ_______L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ���ǣ� ��
A. ����ϡ���ᷴӦ:2Fe+6H+=2Fe3++3H2��
B. ��Ƭ���Ȼ�ͭ��Һ��Ӧ:Fe+Cu2+=Cu+Fe2+
C. ������þ��������:Mg(OH)2+H+=Mg2++H2O
D. Cu(OH)2��ϡ���ᷴӦ:![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�pH ��Ϊ2������һԪ��HA��HB��1mL,�ֱ��ˮϡ��,pH ����Һ����ı仯������ͼ��ʾ������˵����ȷ����

A. HA�����Ա�HB��������
B. a����Һ�ĵ����Ա�c����Һ�ĵ�������
C. ������Һ��ˮϡ�ͣ����������ӵ�Ũ�ȶ���С
D. ��a��b������Һͬʱ�����¶ȣ���c(A-)/c(B-)��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£����ݻ�Ϊ2L�ĺ����ܱ������У���2molN�����3molM�������ϣ��������·�Ӧ��2N(g)+3M(g)![]() xQ(g)+3R(g)��4s��÷�Ӧ��ƽ��ʱ������2.4molR�������Q�ķ�Ӧ����Ϊ0.1mol/��L��s���������й�������ȷ����
xQ(g)+3R(g)��4s��÷�Ӧ��ƽ��ʱ������2.4molR�������Q�ķ�Ӧ����Ϊ0.1mol/��L��s���������й�������ȷ����
A. N��ת����Ϊ80% B. 0��4s�ڣ���������ƽ����Է�����������
C. xֵΪ2 D. ƽ��ʱM��Ũ��Ϊ0.6mol/L
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com