
分析 (1)根据滴定终点,锥形瓶中的溶液颜色发生变化,且半分钟内不褪色;
(2)根据滴定时眼睛应观察锥形瓶内溶液颜色的变化;
(3)根据锥形瓶装液前不能润洗;根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以判断滴定误差;
(4)根据酸式滴定管用蒸馏水洗净后,应用标准液润洗;
(5)根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,V(标准)用两次的平均值;
(6)pH=8,说明溶液呈碱性,碱过量,c(H+)=10-8mol/L,即水电离的c(H+)水,而c(H+)水=c(OH-)水,常温下,Kw=c(H+)c(OH-)=1x10-14.
解答 解:(1)用盐酸滴定氢氧化钠溶液以酚酞作指示剂,终点现象是当滴加最后一滴标准液时,溶液由红色变为无色,且30S内不变色;
故答案为:溶液由红色变为无色,并且30S内不变色;
(2)滴定时眼睛应观察锥形瓶内溶液颜色的变化,以判定终点的到达,故选B;
(3)锥形瓶装液前不能润洗,若锥形瓶用待测液润洗,待测液的物质的量偏多,造成V(标准)增大,根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$分析,c(待测)偏高;若滴定过程中滴定管中有液体外漏于锥形瓶外,造成V(标准)增大,根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$分析,c(待测)偏高;
故答案为:锥形瓶不能用待测液润洗;偏高;偏高;
(4)根据酸式滴定管用蒸馏水洗净后,应用标准液润洗;
故答案为:酸式滴定管用蒸馏水洗净后,应用标准液润洗;
(5)V(标准)═$\frac{{V}_{1}mL+{V}_{2}mL}{2}$═$\frac{{V}_{1}+{V}_{2}}{2}$mL,c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$=$\frac{0.1000×\frac{{V}_{1}+{V}_{2}}{2}}{25.00}$mol/L=$\frac{{V}_{1}+V{\;}_{2}}{500}$mol/L;
故答案为:$\frac{{V}_{1}+V{\;}_{2}}{500}$mol/L;
(6)pH=8,说明溶液呈碱性,碱过量,c(H+)=10-8mol/L,即水电离的c(H+)水,而c(H+)水=c(OH-)水=10-8mol/L,常温下,Kw=c(H+)c(OH-)=1×10-14.
故答案为:10-8mol/L;10-8mol/L;1×10-14.
点评 本题考查中和滴定的操作,误差分析以及有关化学计算,难度中等,掌握中和滴定的原理是解题的关键.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
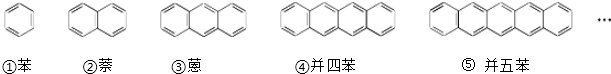
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极得电子反应产物是Mn2O3(s) | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 外电路中每通过O.2mol电子,锌的质量理论上减小6.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式CH2CH2 | |
| B. | 甲基的电子式: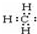 | |
| C. | 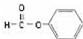 官能团为-COOH 官能团为-COOH | |
| D. | 4-甲基-3-乙基-2-己烯的结构简式为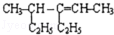 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com