
����Ŀ��
��ԭ�ӿ����γ� �� ������ ������ �� ������λ�����ɼ��Ķ�����ʹ���γ��˶��־��ж�����ɵ����ʡ��ش��� �����⣺
(1)��һ�����ܣ���______��(��������������С����)����̬��ԭ�Ӽ۵����Ų�ͼ����![]() ������ Ϊ���Ų���ʽΥ����__________��
������ Ϊ���Ų���ʽΥ����__________��
(2)��(H2NNH2)�����йµ��Ӷ��� �� ������Ŀ֮��Ϊ______���µ���Է�����������ϩ�ӽ������е�Զ������ϩ��ԭ����______��
( 3)����Ľṹ�ɱ� ʾ Ϊ ![]() ��������ˮ���ӿ� �� ��һˮ�϶�����ᾧ ˮ ���� (2HNO3 H2O) �� ˮ�������������������������ӽ�ϣ���д��һˮ�϶�����Ľṹʽ______(��������������ʾ)��
��������ˮ���ӿ� �� ��һˮ�϶�����ᾧ ˮ ���� (2HNO3 H2O) �� ˮ�������������������������ӽ�ϣ���д��һˮ�϶�����Ľṹʽ______(��������������ʾ)��
(4)��������(Na3NO4)Ϊ��ɫ���壬��һ����Ҫ�Ļ���ԭ�ϡ�
��Na3NO4 �����ӵĿռ乹��Ϊ______��������ԭ���ӻ���ʽΪ______��
�ڷֱ�д��һ���� Na3NO4 �������ӻ�Ϊ�ȵ�����������Ӻͷ���______(�ѧʽ)��
���� 573 K �����£�ʵ�������� NaNO3 �� Na2O �������з�Ӧ�Ƶ� Na3NO4��Na2O ������������ͼ�� ʾ��

ͼ��������ʾ______(����Na+������O2��)��������������ҵȾ����������______����Na2O �����IJ���Ϊ a pm�����ܶ�Ϊ_____gcm3��(�г�����ʽ���ɣ�NA Ϊ�����ӵ�������ֵ)
���𰸡����� ���ع��� 2:5 �·��Ӽ�����������ϩ���Ӽ������ ![]() �������� sp3 SO42-��CCl4 O2- 8
�������� sp3 SO42-��CCl4 O2- 8 
��������
��1����̬��ԭ�ӵ�2p���Ϊ�ȶ��İ����״̬��������Ԫ��ԭ����ʧȥ���ӣ����ݺ��ع����ӷֲ���������ͬ�Ĺ��ʱ��������������ͬ�ķ�ʽռ�ݲ�ͬ�����
��2���µĽṹʽΪ![]() ��ÿ����ԭ�Ӹ���һ���µ��Ӷԣ�ÿ����������2���µ��Ӷԣ�5����������5��
��ÿ����ԭ�Ӹ���һ���µ��Ӷԣ�ÿ����������2���µ��Ӷԣ�5����������5��![]() �������к��������
��������������
��3��ˮ�������������������������ӽ��������γ�λ��д���ṹʽ��
��4����![]() �����ӵ�����ԭ��Ϊ
�����ӵ�����ԭ��Ϊ![]() ���۲���Ӷ���Ϊ
���۲���Ӷ���Ϊ![]() ��
��
����![]() �������ӻ�Ϊ�ȵ�����������Ӻͷ���Ӧ�þ���5��ԭ�ӣ�32���۵��ӣ�
�������ӻ�Ϊ�ȵ�����������Ӻͷ���Ӧ�þ���5��ԭ�ӣ�32���۵��ӣ�
��Na2O ������������ԭ�Ӹ�������ϻ�ѧʽ�ж��������࣬���ù�ʽ![]() �����㾧���ܶȡ�
�����㾧���ܶȡ�
��1����̬��ԭ�ӵ�2p���Ϊ�ȶ��İ����״̬��������Ԫ��ԭ����ʧȥ���ӣ���˵�һ�����ܣ������������ݺ��ع����ӷֲ���������ͬ�Ĺ��ʱ��������������ͬ�ķ�ʽռ�ݲ�ͬ���������еĵ����Ų�ͼ�У�������2p��ͬһ��������Ų������������෴�ĵ��ӣ�Υ���˺��ع���
�ʴ�Ϊ�����ڣ����ع���
��2���µĽṹʽΪ![]() ��ÿ����ԭ�Ӹ���һ���µ��Ӷԣ�ÿ����������2���µ��Ӷԣ�5����������5��
��ÿ����ԭ�Ӹ���һ���µ��Ӷԣ�ÿ����������2���µ��Ӷԣ�5����������5��![]() ������˹µ��Ӷ���
������˹µ��Ӷ���![]() ������Ŀ֮��Ϊ2:5��Hԭ����N��O��F��ԭ���γɹ��ۼ�ʱ�����Ӽ�ͨ���ܹ��γ����������۷е����ߣ������µķе�Զ������ϩ��
������Ŀ֮��Ϊ2:5��Hԭ����N��O��F��ԭ���γɹ��ۼ�ʱ�����Ӽ�ͨ���ܹ��γ����������۷е����ߣ������µķе�Զ������ϩ��
�ʴ�Ϊ��2:5���·��Ӽ�����������ϩ���Ӽ������
��3��ˮ�������������������������ӣ������ΪH��N��O��F֮����ڵļ�����һˮ�϶�����ĽṹʽΪ![]() ��
��
�ʴ�Ϊ��![]() ��
��
��4����![]() �����ӵ�����ԭ��Ϊ
�����ӵ�����ԭ��Ϊ![]() ���۲���Ӷ���Ϊ
���۲���Ӷ���Ϊ![]() ���ӻ���ʽΪ
���ӻ���ʽΪ![]() ���ռ乹��Ϊ�������壻
���ռ乹��Ϊ�������壻
�ʴ�Ϊ���������壻![]() ��
��
����![]() �������ӻ�Ϊ�ȵ����������ͷ���Ӧ�þ���5��ԭ�ӣ�32���۵��ӣ�����Ҫ�����������
�������ӻ�Ϊ�ȵ����������ͷ���Ӧ�þ���5��ԭ�ӣ�32���۵��ӣ�����Ҫ�����������![]() �ȣ�����Ҫ��ķ�����
�ȣ�����Ҫ��ķ�����![]() �ȣ�
�ȣ�
�ʴ�Ϊ��SO42-��CCl4�ȣ�
���ɾ���ʾ��ͼ��֪��������![]() ����������Ϊ8����ѧʽΪNa2O��������ʾO2-��������ʾNa+���ɾ���ʾ��ͼ��֪������������ҵȾ����������8���������ܶ�
����������Ϊ8����ѧʽΪNa2O��������ʾO2-��������ʾNa+���ɾ���ʾ��ͼ��֪������������ҵȾ����������8���������ܶ�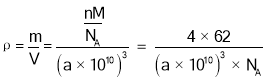 ��
��
�ʴ�Ϊ��O2-��8�� ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ�����Ԫ�������ڱ��е�λ����ͼ������ֻ��MΪ����Ԫ�ء�����˵������ȷ�ģ� ��

A.ԭ�Ӱ뾶Z<M
B.X�������̬�⻯������ȶ��Ա�Z��С
C.Y������������Ӧˮ��������Ա�X����
D.Zλ��Ԫ�����ڱ��еڶ����ڵڢ�A��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�н����н϶�Ca2+��Mg2+��ˮ��ΪӲˮ���ⶨijˮ��ĸ�Ӳ�ȡ�þӲ�ȣ�ÿ��ˮ�к�Ca2+��Mg2+����������λmg/L���Ĺ������£�
��ȡ50.00mLˮ����������Һ��pH=10���Ը���TΪָʾ������0.01000mol/LEDTA����Һ�ζ�Ӳˮ�иƺ�þ���ܺ������յ㣬����EDTA����Һ30.00mL��
����ȡ50.00mLˮ��������10%NaOH��Һ��pH=12.5�������ָʾ������001000mol/LEDTA����Һ�ζ�Ӳˮ�иƵĺ������յ㣬����EDTA����Һ20.00mL��
��֪��Ca2+��Mg2+��EDTA��Ӧ�Ļ�ѧ֭���Ⱦ�Ϊ1��1��
��1����Ӳˮ�м���ʯ�ң���ʹCa2+��Mg2+�������Դﵽ����Ӳˮ��Ŀ�ģ�д��Ca(OH)2��Ca(HCO3)2��Ӧ�Ļ�ѧ����ʽ��___��
��2��������10%NaOH��Һ��pH=12.5����Ŀ����___��
��3�������ˮ���ĸ�Ӳ�ȡ�þӲ�ȣ�д��������̣�___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС���ͬѧΪ����֤�����Ļ�ѧ��ɣ�����������ʵ�飺
��1����������ˮ��Һ�ֱ�������Թ��У�����ɫ��Ӧ������ɫ�ܲ����۲����Ϊ��ɫ��˵������________________��
��2��������һ���Թ��У����������ˮ������������ɫ��������������Ϊ�����֣��ֱ���������������������ƣ�����������˵��������Һ�к�____________(���ӷ���)��д����ɫ����������������Һ��Ӧ�����ӷ���ʽ________________________________________________��
��3������һ���Թ��У����������ữ�����Ȼ�����Һ��������ɫ������˵��������Һ�к�____________________________ (���ӷ���);
��4������ˮ��Һ��pHֵ________7����ԭ����________________________________ (���ӷ���ʽ);��������������ˮ������ԭ����____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ũ���ᷴӦ��ʵ��Ľ�װ����ͼ��ʾ������˵���������
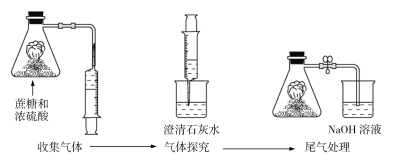
A.�Ľ�װ�ú��ж����屻��Һ���գ�ʵ������ɫ����
B.Ũ������ʵ���������������ˮ�Ժ�ǿ������
C.������������ʹ����ʯ��ˮ����ǣ�˵��������CO2
D.�÷�Ӧ�ȽϾ��ҡ�Σ�գ�ʵ������ʵ�����Ӧ��Ҫ��淶����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2��0mol/L HCl��Һ����100mL 0��10mol/L HCl��Һ������Ҫ��������
A.![]() B.
B. C.
C.![]() D.
D.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ����ʽ�в���ȷ����
A.����������ȼ�յķ�Ӧ��2Fe+3Cl2![]() 2FeCl3
2FeCl3
B.��ˮ��ϡ����ķ�Ӧ��NH3��H2O+H+=H2O+![]()
C.����������������Һ�ķ�Ӧ��Cl2+2OH��=Cl��+ClO��+H2O
D.ͭ��ϡ����ķ�Ӧ��Cu+2H++NO2=Cu2++NO��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڹ�̬��������������У����¹����H2O��CO2��������Ʊ�H2��CO��һ���µ���Դ���÷�ʽ������ԭ����ͼ��ʾ������˵������ȷ���ǣ� ��
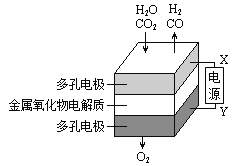
A.�������������ɵ���������ʵ���֮����1�U2
B.X�ǵ�Դ�ĸ���
C.�����ķ�Ӧʽ�ǣ�H2O��2e-=H2��O2- CO2��2e-=CO��O2-
D.�ܷ�Ӧ�ɱ�ʾΪ��H2O��CO2![]() H2��CO��O2
H2��CO��O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͳ�Ķ�����ѧʵ���ܵ������ֶε���Լ���о���Χ��խ����ȷ�Ȳ��ߡ�DIS���ֻ���Ϣϵͳ���ɴ����������ݲɼ����ͼ������ɣ���Ϊ����ȷ������Һ��pH�ȶ����к͵ζ����о���Ӧ��Խ��Խ�㷺���롣

��1��ijѧϰС������DISϵͳ̽��ǿ��Ͳ�ͬ����кͷ�Ӧ��ʵ��������£�
�ٷֱ�����0.1000mol/L��NaOH��HCl��CH3COOH��Һ���á�
����0.1000mol/L��NaOH��Һ�ֱ�ζ�10.00mL0.1000mol/L��HCl��CH3COOH��Һ���������ݲɼ�����pH��������
���ɼ�������Ƶĵζ�������ͼһ��
������ͼ��㲻ͬ��ԭ����_____��������ͼ��V1_____V2 �����������������������
��2����һ��ѧϰС������DISϵͳ�ⶨij������Һ�����ʵ���Ũ�ȣ��Բ�����Һ�����������жϵζ��յ㣬ʵ�鲽�����£�
����_____�����������ƣ���ȡ20.00mL������Һ��Ʒ������ྻ������ƿ�У����Ӻ�DISϵͳ�������ƿ�к���������ˮ���Ƿ��Ӱ��������_____����ǡ�������������ȷ������������ƿ�еμ�0.1000mol/L��NaOH��Һ���������Ļ����ʾ����Һ�������������NaOH��Һ�����ϵ������ͼ����ͼ������
�ڴ�����NaOH��Һ��Ӧ�����ӷ���ʽΪ___________________________��
��ͼ��b��ʱ����Һ�и�����Ũ�ȴ�С�Ĺ�ϵ��_____________________��
����ͼ��ijһ��pH����8����c(Na+)��c(CH3COO��)�ľ�ȷֵΪ_____mol/L��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com