
| A. | 金刚石比石墨稳定 | |
| B. | 1 mol石墨所具有的能量比1 mol金刚石低 | |
| C. | 金刚石转变成石墨是物理变化 | |
| D. | 石墨和金刚石都是碳的同位素 |
分析 根据石墨、金刚石燃烧的热化学方程式,利用盖斯定律写出金刚石与石墨转化的热化学方程式,根据反应热比较金刚石与石墨的能量大小.
解答 解:①C(石墨)+O2(g)=CO2(g)△H=-393.51kJ•mol-1,②C(金刚石)+O2(g)=CO2(g)△H=-395.41kJ•mol-1,
①-②可得:C(石墨)=C(金刚石)△H=+1.9kJ•mol-1,
A.石墨转化为金刚石吸热,金刚石能量大于石墨的总能量,物质的量能量越大越不稳定,则石墨比金刚石稳定,故A错误;
B.石墨转化为金刚石吸热,金刚石能量大于石墨的总能量,故B正确;
C.金刚石和石墨是不同的物质,石墨转化为金刚石是化学变化,故C错误;
D.石墨和金刚石都是碳的同素异形体,故D错误.
故选B.
点评 本题考查反应热,侧重于金刚石和石墨的转化,题目难度不大,注意盖斯定律的运用以及物质的能量与稳定性的关系.


科目:高中化学 来源: 题型:解答题
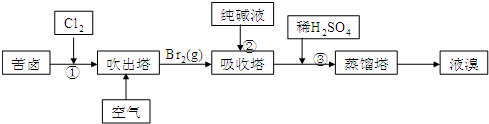
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
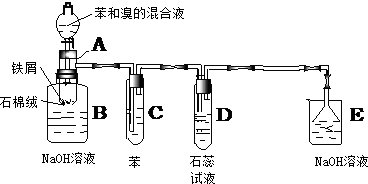

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该物质在水中的溶解度大 | |
| B. | 该物质的水溶液导电能力强 | |
| C. | 该物质的水溶液中不存在溶质分子 | |
| D. | 该物质的水溶液中不存在除水外的电离平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾起催化作用 | B. | 硫酸铝钾比碳酸氢钠更易分解 | ||
| C. | 明矾受热分解放出气体 | D. | 铝盐在水中能起到酸的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH(CH2CH3)CH2CH3 2-乙基丁烷 | B. | CH2CHBr2 二氯乙烷 | ||
| C. | CH3CH(CH3)CH=CH2 2-甲基丁烯 | D. | 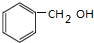 苯甲醇 苯甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32gO2和32gO3的质子数均为16NA | |
| B. | 23gNa与O2在加热条件充分反应,O2得到的电子数为2NA | |
| C. | 在标准状况下,22.4LSO3所含分子数为NA | |
| D. | 2 L1mol•L-1的HC1溶液中,含有的HC1分子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 向澄清石灰水中通入过量CO2:OH-+CO2═HCO3- | |
| D. | 将0.1mol/L的NH4Al(SO4)2溶液与0.3mol/L的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | .电池工作时,MnO2发生还原反应 | |
| B. | .电池负极的电极反应式为:2MnO2+H2O+2e-→Mn2O3+2OH- | |
| C. | .电池工作时,电路中每通过0.2mol电子,锌的质量理论上减少6.5g | |
| D. | 电池工作时,K+移向负极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com