
【题目】Mg / LiFePO4电池的电池反应为xMg2++2LiFePO4![]() xMg+2Li1-xFePO4+2xLi+,其装置示意图如下:
xMg+2Li1-xFePO4+2xLi+,其装置示意图如下:

下列说法正确的是
A. 放电时,Li+被还原
B. 充电时,电能转变为化学能
C. 放电时,电路中每流过2mol电子,有1molMg2+迁移至正极区
D. 充电时,阳极上发生的电极反应为LiFePO4-xe-= Li1-xFePO4 + xLi+
【答案】BD
【解析】
根据装置图,以及原电池工作原理,Mg极为负极,其电极反应式为Mg-2e-=Mg2+,正极反应式为Li1-xFePO4+xe-+xLi+=LiFePO4,然后根据原电池的工作原理进行分析;
根据装置图,以及原电池工作原理,Mg极为负极,其电极反应式为Mg-2e-=Mg2+,正极反应式为Li1-xFePO4+xe-+xLi+=LiFePO4,
A、根据上述分析,放电时,Li+的化合价没有发生变化,故A错误;
B、充电为电解池,将电能转化成化学能,故B正确;
C、根据装置图,交换膜是锂离子导体膜,Mg2+不能移向正极区,故C错误;
D、充电是电解池,根据电解原理,阳极反应式为LiFePO4-xe-= Li1-xFePO4 + xLi+,故D正确;


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】在一个容积固定的反应器中,有一可左右滑动的密封隔板,左、右两侧分别进行如下可逆反应:2SO2(g)+O2(g) ![]() 2SO3(g);3Fe(s)+4H2O(g)
2SO3(g);3Fe(s)+4H2O(g) ![]() Fe3O4(s)+4H2(g)。左侧中加入SO2、O2、SO3的物质的量分别为xmol、3.25mol、1mol;右侧中加入9mol的水蒸气和适量的铁粉(忽略铁粉对容器体积的影响)当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器位置2处
Fe3O4(s)+4H2(g)。左侧中加入SO2、O2、SO3的物质的量分别为xmol、3.25mol、1mol;右侧中加入9mol的水蒸气和适量的铁粉(忽略铁粉对容器体积的影响)当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器位置2处![]() 请填写以下空白:
请填写以下空白:

(1)若x=1.5则左侧反应在起始时向 ______(填“正反应”或“逆反应”)方向进行![]() 欲使反应维持向该方向进行,则x的取值范围是 ______ 。
欲使反应维持向该方向进行,则x的取值范围是 ______ 。
(2)若X=2,则左侧反应在起始时向 ______填“正反应”或“逆反应”)方向进行,平衡时混合气中SO2所占的体积分数为 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下,同体积的甲烷(CH4)和二氧化碳物质的量之比为__________,原子总数之比为__________,密度之比为__________。
(2)在标准状况下,4 g H2、11.2 L O2、1 mol H2O中,所含分子数最多的是__________,含原子数最多的是__________,质量最大的是__________,体积最小的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知:① NaHCO3(s)==Na+(ag)+HCO3-(aq) △H=+18.81kJ·mo1-1
②Na2CO3(s)==2Na+(aq)+CO32-(aq)△H=-16.44 k J· mol-1
③2NaHCO3(s)==Na2CO3(s)+CO2(g)+H2O(1) △H=+92.34kJ·mol-1
请回答:
(1)资料显示,NaHCO3固体加热到100℃发生分解,但是加热 NaHCO3溶液不到80℃就有大量CO2气体放出,用反应热角度说明原因_________________________________。
(2) NaHCO3溶液中主要存在2种化学平衡:a.HCO3-+H2O![]() H2CO3+OH-,b.2HCO3-
H2CO3+OH-,b.2HCO3-![]() CO32-+H2O+CO2。根据理论计算0.10 mol·.L-1 NaHCO3溶液中2个反应的转化率随温度变化如图所示(不考虑相互影响):
CO32-+H2O+CO2。根据理论计算0.10 mol·.L-1 NaHCO3溶液中2个反应的转化率随温度变化如图所示(不考虑相互影响):

①计算25℃0.10mol·L-1NaHCO3溶液中CO2与H2CO3的总浓度最大可能为___________mol·L-1。
②加热蒸干NaHCO3溶液最后得到的固体是___________。
③25℃时0.10mol·L-1的NaHCO3溶液pH=8.3,加热到4分钟溶液沸腾,后保温到7分钟。已知常温下Na2CO3溶液浓度和pH的关系如下表(忽略温度对Kw的影响):
c(mo1·L-1) | 饱和 | 0.20 | 0.10 | 0.010 | 0.0010 |
pH | 12.1 | 11.8 | 11.5 | 11.1 | 10.6 |
请在图中作出 NaHCO3溶液pH随时间变化曲线______________

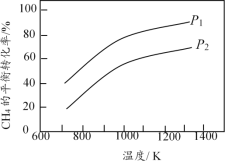
II.研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图

(1)T℃时,向1L恒容密闭容器中充入0.3 mol CH4,只发生反应2CH4(g)![]() C2H4(g)+2H2(g),达到平衡时,c(C2H4)=c(CH4
C2H4(g)+2H2(g),达到平衡时,c(C2H4)=c(CH4
(2)列式计算反应2CH4(g)![]() C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=___________(用平衡分压代替平衡浓度计算,1g0.05=-1.3)
C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=___________(用平衡分压代替平衡浓度计算,1g0.05=-1.3)
(3)由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
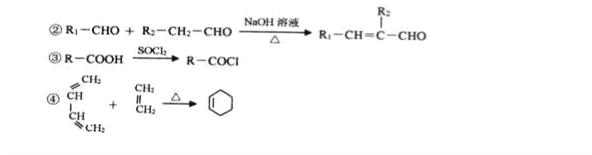
【题目】某新型有机酰胺化合物M在工业生产中有重要的作用,其合成路线如下:

已知:①A是烃的含氧衍生物,相对分子质量为58,碳和氢的质量分数之和为44.8%,核磁共振氢谱显示为一组峰,可发生银镜反应。
回答下列问题;
(1)E的结构简式为________________,G的名称为_____________。
(2)B中含有官能团的名称为__________________
(3)C→D的反应类型为_____________。
(4)写出B→C的化学反应方程式____________________________.F+H→M的化学反应方程式____________________________
(5)芳香族化合物W有三个取代基,是C的同分异构体,能与FeCl3溶液发生显色反应。0.5molW可与足量的Na反应生成1gH2,且核磁共振氢谱显示为五组峰,符号以上条件的W的同分异构体共有__________种,写出其中一种的结构简式______________。
(7)参照上述合成路线,以C2H4和HOCH2CH2OH为原料(无机试剂任选),设计制备OHC-CH=CH-CHO的合成路线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个容积相同的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下发生反应CH4(g)+ H2O(g) ![]() CO(g) + 3H2(g)(不发生其他反应),CH4的平衡转化率与温度、压强的关系如图所示。
CO(g) + 3H2(g)(不发生其他反应),CH4的平衡转化率与温度、压强的关系如图所示。
容器 | 起始物质的量/mol | CH4的平衡 转化率 | |||
CH4 | H2O | CO | H2 | ||
Ⅰ | 0.1 | 0.1 | 0 | 0 | 50% |
Ⅱ | 0.1 | 0.1 | 0.1 | 0.3 | / |
Ⅲ | 0 | 0.1 | 0.2 | 0.6 | / |
下列说法错误的是
A. 该反应的![]() H>0,图中压强P1>P2
H>0,图中压强P1>P2
B. 起始时,容器Ⅱ中v(CH4)正<v(CH4)逆
C. 达到平衡时,容器Ⅰ、Ⅱ中CO的物质的量满足:n(CO)Ⅱ< 2n(CO)Ⅰ
D. 达到平衡时,容器Ⅱ、Ⅲ中气体的总压强之比PⅡ∶PⅢ = 4∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应ClF(g)+F2(g) ![]() ClF3(g) △H = -268 kJ·mol-1 在密闭容器中达到平衡。下列说法正确的是 ( )
ClF3(g) △H = -268 kJ·mol-1 在密闭容器中达到平衡。下列说法正确的是 ( )
A. 温度不变,缩小体积,ClF的转化率增大
B. 温度不变,增大体积,ClF3产率提高
C. 升高温度,增大体积,有利于平衡向正反应方向移动
D. 降低温度,体积不变,F2转化率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:

(1)从反应开始到10 s,用Z表示的反应速率为____________Y的转化率为_____________。
(2)该反应的化学方程式为____________________________。
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示:则下列说法符合该图像的是___________。

A.t1时刻,增大了X的浓度
B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积
D.t1时刻,使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL H2A溶液中滴加0.1mol/L NaOH溶液.有关微粒的物质的量变化如图.根据图示判断,下列说法不正确的是

A. H2A是二元弱酸
B. 当0 mL<V(NaOH)<20 mL时,一定有:c(OH﹣)+c(HA﹣)+2c(A2﹣)=c(Na+)+c(H+)
C. 当V(NaOH)=10 mL时,溶液中离子浓度关系一定有:c(Na+)>c(HA﹣)>c(H+)>c(A2﹣)>c(OH﹣)
D. 当V(NaOH)=20 mL后,再向溶液中加水稀释,c(H+)减小,c(OH﹣)也减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com