
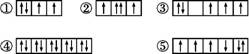
(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况。试判断,违反了泡利原理的是 , 违反了洪特规则的是 。
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子
排布式为 ;其最高价氧化物对应水化物的化学式是 。
(3)用符号“>”“<”或“=”表示下列各项关系。
①第一电离能:Na Mg, Mg Ca。
②电负性:O F, F Cl。
③能量高低:ns (n+1)s, ns np。
④主族序数 价电子数 元素最高正化合价。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
NA代表阿伏伽德罗常数。已知C2H4和C3H6的混合物的质量为ag,则该混合物( )
A.所含共用电子对数目为(a/7+1)NA B.所含碳氢键数目为aNA/7
C.燃烧时消耗的O2一定是33.6a/14L D.所含原子总数为aNA/14
查看答案和解析>>
科目:高中化学 来源: 题型:
下列现象与氢键有关的是( )
①NH3的熔沸点比第ⅤA族相邻元素的氢化物高
②NH3易溶于水
③冰的密度比液态水的密度小
④尿素的熔沸点比醋酸的高
⑤邻羟基苯甲酸的熔沸点比对羟基苯甲酸的低
⑥水分子高温下也很稳定
A.①②③④⑤⑥ B.①②③④⑤
C.①②③④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
氯化硼的熔点为10.7 ℃,沸点为12.5 ℃。在氯化硼分子中,氯—硼—氯键角为120°,它可以水解,水解产物之一是氯化氢。下列对氯化硼的叙述中正确的是( )
A.氯化硼是原子晶体
B.熔化时,氯化硼能导电
C.氯化硼是一种离子晶体
 D.水解方程式:BCl3+3H2O H3BO3+3HCl
D.水解方程式:BCl3+3H2O H3BO3+3HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
在20 L的密闭容器中按物质的量之比为1∶2充入CO和H2,发生:CO(g)+2H2(g)CH3OH(g) ΔH。测得CO的转化率随温度及不同压强下的变化如图所示,p2和195 ℃时n(H2)随时间的变化结果如表所示。下列说法正确的是( )
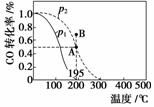
p2及195 ℃ n(H2)随时间变化
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
A.p1>p2,ΔH<0
B.在p2及195 ℃时,反应前3 min的平均速率v(CH3OH)=0.8 mol·L-1·min-1
C.在p2及195 ℃时,该反应的平衡常数为25
D.在B点时,v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g)2SO3(g) ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ,则下列分析正确的是( )
A.在该条件下,反应前后的压强之比为1∶1
B.若反应开始时容器容积为2 L,则v(SO3)=0.35 mol·L-1·min-1
C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol
D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
电解尿素[CO(NH2)2]的碱性溶液制氢气的装置示意图如下:
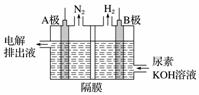
电解池中隔膜仅阻止气体通过,阴阳两极均为惰性电极。
(1)A极为________,电极反应式为___________________________________________。
(2)B极为________,电极反应式为__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.第二周期元素从C到F,非金属性逐渐减弱
B.第三周期元素从Na到Cl,原子半径逐渐增大
C.HF、HCl、HBr、HI的热稳定性依次逐渐减弱
D.LiOH、NaOH、KOH的碱性依次逐渐减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com