
【题目】(题文)某研究小组制备氯气并对产生氯气的条件进行探究。
(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的______(填“氧化性”或“还原性”)。
(2)A中产生的气体不纯,含有的杂质可能是______。
(3)B用于收集Cl2,请完善装置B并用箭头标明进出气体方向。____________
(4)C用于吸收多余的Cl2,C中发生反应的离子方程式是______。
(5)该小组欲研究盐酸的浓度对制Cl2的影响,设计实验进行如下探究。
实验 | 操作 | 现象 |
I | 常温下将MnO2和12 mol·L-1浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
II | 将I中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
III | 加热MnO2和4 mol·L-1稀盐酸混合物 | 无明显现象 |
①已知MnO2呈弱碱性。I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是________。
②II中发生了分解反应,反应的化学方程式是________。
③III中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验IV进行探究:
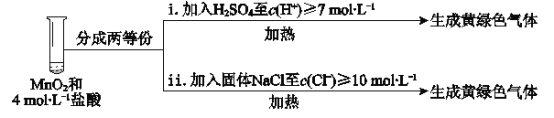
将实验III、IV作对比,得出的结论是________;将i、ii作对比,得出的结论是_______。
【答案】还原性HCl 、H2O(g) Cl2 + 2OH— ====== Cl— + ClO— + H2OMnO2 + 4HCl
Cl2 + 2OH— ====== Cl— + ClO— + H2OMnO2 + 4HCl![]() MnCl4 + 2H2OMnCl4 ====== Cl2↑ + MnCl2III中没有明显现象的原因是c(H+)、c(Cl-) 较低,需要增大到一定浓度才能被MnO2氧化MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-)
MnCl4 + 2H2OMnCl4 ====== Cl2↑ + MnCl2III中没有明显现象的原因是c(H+)、c(Cl-) 较低,需要增大到一定浓度才能被MnO2氧化MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-)
【解析】
试题(1)MnO2与浓盐酸反应制取Cl2的反应中,氯元素化合价由-1升高为0;(2)浓盐酸具有挥发性;(3)氯气密度大于空气,用向上排空气法收集氯气;(4)氯气与氢氧化钠溶液反应生成次氯酸钠和氯化钠;(5)①I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,复分解反应中元素化合价不变,所以MnO2与浓盐酸反应生成MnCl4和水;②II中MnCl4发生了分解反应生成MnCl2和氯气;③III、IV作对比,可以看出c(H+)或c(Cl-)增大到一定数值时都能生成氯气;将i、ii作对比,可以看出c(H+) >7mol/L放出氯气、c(Cl-) >10mol/L放出氯气;
解析:(1)MnO2与浓盐酸反应制取Cl2的反应中,氯元素化合价由-1升高为0,所以浓HCl发生氧化反应,表现浓盐酸的还原性;(2)由于浓盐酸具有挥发性,A中产生的Cl2中含有的杂质可能是HCl 、H2O(g);(3)氯气密度大于空气,用向上排空气法收集氯气,所以装置如图 ;(4)氯气与氢氧化钠溶液反应生成次氯酸钠和氯化钠,反应的离子方程式是Cl2 + 2OH— == Cl— + ClO— + H2O;(5)①I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,复分解反应中元素化合价不变,所以MnO2与浓盐酸反应生成MnCl4和水,反应方程式是MnO2 + 4HCl
;(4)氯气与氢氧化钠溶液反应生成次氯酸钠和氯化钠,反应的离子方程式是Cl2 + 2OH— == Cl— + ClO— + H2O;(5)①I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,复分解反应中元素化合价不变,所以MnO2与浓盐酸反应生成MnCl4和水,反应方程式是MnO2 + 4HCl![]() MnCl4 + 2H2O;②II中MnCl4发生了分解反应生成MnCl2和氯气,反应的化学方程式是MnCl4 == Cl2↑ + MnCl2;③III中没有明显现象的原因是c(H+)、c(Cl-) 较低,盐酸需要增大到一定浓度才能被MnO2氧化;将i、ii作对比,可以看出c(H+) >7mol/L放出氯气、c(Cl-) >10mol/L放出氯气;MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-)。
MnCl4 + 2H2O;②II中MnCl4发生了分解反应生成MnCl2和氯气,反应的化学方程式是MnCl4 == Cl2↑ + MnCl2;③III中没有明显现象的原因是c(H+)、c(Cl-) 较低,盐酸需要增大到一定浓度才能被MnO2氧化;将i、ii作对比,可以看出c(H+) >7mol/L放出氯气、c(Cl-) >10mol/L放出氯气;MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-)。


科目:高中化学 来源: 题型:
【题目】随着科学技术的不断进步,研究物质的手段和途径越来越多,H3、O4、C60、N5+等已被发现。下列有关说法中,正确的是( )
A.H2与H3中不存在氢键B.O2 与O4互为同位素
C.C60 分子中有范德华力D. N5+中含有35个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.10mol/L的氨水滴定10.00mL a mol/L的盐酸,混合溶液的pH与氨水的体积(V)的关系如图所示。已知N点溶液中存在:c(H+)=c(0H-)+c(NH3H2O),下列说法不正确的是
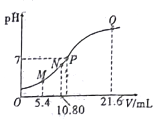
A. 图上四点离子种类相同
B. a=0.108
C. N、Q两点的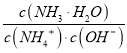 : N>Q
: N>Q
D. M点溶液中存在:c(H+)=c(OH-)+2(NH3H2O) +c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为某城市某日空气质量报告,下列叙述与报告内容不相符的是

A. 该日空气首要污染物是PM10
B. 该日空气质量等级属于中度污染
C. 污染物NO2、CO可能主要来源于机动车尾气
D. PM2.5、PM10指的是悬浮颗粒物,会影响人体健康
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表与元素周期律在学习、研究和生产实践中有重要的作用。下表列出①~⑩十种元素在周期表中的位置。请用化学用语回答下列问题:
| IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑤ | ⑧ | ||||||
3 | ① | ③ | ④ | ⑦ | ⑨ | |||
4 | ② | ⑥ | ⑩ |
(1)②的元素符号是________。
(2)在①、②、③三种元素中,原子半径由大到小的顺序依次是________。
(3)①、⑧二种元素形成的化合物,在高温下灼烧,火焰呈________。
(4)⑦、⑨二种元素的最高价氧化物对应水化物的酸性较强的是________,用原子结构理论解释:________。
(5)⑤元素的氢化物实验室制法的化学方程式是________。此反应的能量变化示意图如右图所示,该反应是______反应(选填“放热”或“吸热”),判断依据是______。

(6)对⑥元素的说法正确的是________(填字母)。
a. ⑥的非金属性强于⑤
b. 氢化物稳定性:⑥<⑩
c. 最高价氧化物对应水化物的酸性:⑥<⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如题图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是( ) 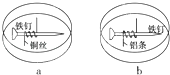
A.a中铁钉附近呈现红色
B.b中铁钉上发生还原反应
C.a中铜丝上发生氧化反应
D.b中铝条附近有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.回答以下问题: 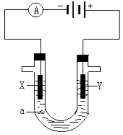
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边 各滴入几滴酚酞溶液,在 X极附近观察到的现象是:
(2)Y电极上的电极反应式是 , 检验该电极反应产物的方法是:
(3)如果用电解方法精炼粗铜(粗铜中含有杂质锌和银),电解液a选用CuSO4溶液,则Y 电极的材料是 , 电极反应式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项关于铜电极的叙述正确的是( )
A. 铜锌原电池中铜是负极
B. 用电解法精炼粗铜时粗铜作阴极
C. 在镀件上镀铜时可用金属铜作阳极
D. 电解稀硫酸制H2、O2时铜作阳极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com