

Ēėøł¾ŻĶ¼Ź¾¹ŲĻµ£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)Š“³öĻĀĮŠĪļÖŹµÄ»ÆѧŹ½£ŗ³Įµķ¢Ū____________£¬ČÜŅŗ¢į(ČÜÖŹ)____________”£
(2)Š“³öĻĀĮŠ·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ
¢Ś”ś¢Ž____________________________________”£
¢ß”ś¢Ü____________________________________”£
(3)»ģŗĻČÜŅŗ¢ŁÖŠµÄĮ½ČÜÖŹAŗĶBæÉÄÜ“ęŌŚ¶ąÖÖ×éŗĻ£¬½«ĘäæÉÄܵÄ×éŗĻÖŠAŗĶBµÄ»ÆѧŹ½¼°ĘäĪļÖŹµÄĮænA”¢nB¼äÓ¦Āś×ćµÄŹżŃ§¹ŲĻµŹ½ĢīČėĻĀ±ķÖŠ(ČĪĢīĮ½ÖÖ)”£
×éŗĻ | A | B | nAÓėnBµÄ¹ŲĻµ |
¢ń |
|
|
|
¢ņ |
|
|
|
(1)S H2SO4
(2)H2S+2OH-![]() S2-+2H2O
S2-+2H2O ![]() +Br2+H2O
+Br2+H2O![]()
![]() +2Br-+2H+»ņ
+2Br-+2H+»ņ![]() + Br2+H2O
+ Br2+H2O![]()
![]() +2Br-+3H+
+2Br-+3H+
(3)Na2S£¬Na2SO4£¬![]() £¾2 Na2S£¬NaHSO3£¬
£¾2 Na2S£¬NaHSO3£¬![]() £¾2 NaHS£¬Na2SO3£¬
£¾2 NaHS£¬Na2SO3£¬![]() £¾2 NaHS£¬NaHSO3£¬
£¾2 NaHS£¬NaHSO3£¬![]() £¾2 Na2S£¬Na2S2O3£¬
£¾2 Na2S£¬Na2S2O3£¬![]() £¾2µČ(ČĪŃ”Į½Ļī)
£¾2µČ(ČĪŃ”Į½Ļī)
½āĪö£ŗ±¾ĢāÄŃ¶Č½Ļ“ó£¬ŌŚ½āĢāŹ±æÉŅŌ“ÓĘųĢå¢Ś”śĘųĢå¢Ż”śĘųĢå¢ąÕāŅ»×Ŗ»Æ¹ŲĻµČėŹÖ£¬ĶĘ³ö³Įµķ¢ŪŹĒµ„ÖŹĮņ”¢ĘųĢå¢ŚŹĒĮņ»ÆĒā£¬“Ó¶ųÖš²½µĆ³öø÷ĪļÖŹµÄ³É·Ö£¬ŌŚŹéŠ“¢Ś”ś¢ŽµÄĄė×Ó·½³ĢŹ½Ź±£¬ŅŖ×¢ŅāNaOHČÜŅŗŹĒ¹żĮæµÄ£¬Ö»ÄÜÉś³ÉNa2S£¬¶ų²»ÄܵƵ½NaHS£¬ŌŚŹéŠ“¢ß”ś¢ÜµÄĄė×Ó·½³ĢŹ½Ź±£¬Ó¦×¢Ņā¢ßæÉÄÜŹĒNa2SO3Ņ²æÉÄÜŹĒNaHSO3”£(3)ÖŠ¹Ų¼üŌŚÓŚA”¢BµÄæÉÄÜ×éŗĻ£¬ÓÉÓŚA”¢BµÄ»ģŗĻŅŗÓėĮņĖį·“Ӧɜ³ÉĮņ»ÆĒā”¢ĮņŗĶĮņĖįÄĘ(»ņĮņĖįĒāÄĘ)ČżÖÖĪļÖŹ£¬Ņņ“ĖA”¢BæÉÄÜŹĒNa2SŗĶNa2SO3”¢NaHSŗĶNa2SO3”¢Na2SŗĶNaHSO3”¢NaHSŗĶNaHSO3”¢Na2SŗĶNa2S2O3µČ”£


 ½ĢѧĮ·ŠĀĶ¬²½Į·Ļ°ĻµĮŠ“š°ø
½ĢѧĮ·ŠĀĶ¬²½Į·Ļ°ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ±±¾©ŹŠŗ£µķĒų2009½ģøßȿ𼶵ŚŅ»Ń§ĘŚĘŚÖŠĮ·Ļ°»ÆѧŹŌĢā ĢāŠĶ£ŗ022
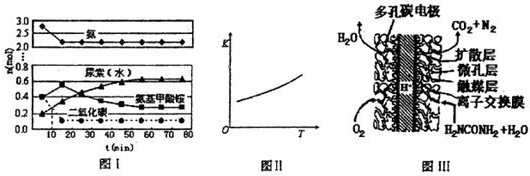
AŗĶRŌŚŅ»¶ØĢõ¼žĻĀæÉŗĻ³É·¼Ļć×å»ÆŗĻĪļE£¬ŅŃÖŖAæÉŅŌŌŚŅ»¶ØĢõ¼žĻĀ×Ŗ»ÆĪŖG£¬ĒŅGŌŚ±ź×¼×“æöĻĀĆܶČĪŖ1.25 g/L£®ø÷ĪļÖŹ¼äĻą»„×Ŗ»Æ¹ŲĻµČēĻĀĶ¼ĖłŹ¾(ijŠ©Ģõ¼žŅŃĀŌČ„)£®
(1)AÖŠĖłŗ¬¹ŁÄÜĶŵÄĆū³ĘĪŖ________£»¢ŁµÄ·“Ó¦ĄąŠĶĪŖ________£®
(2)¢ŚµÄ»Æѧ·“Ó¦·½³ĢŹ½ĪŖ________£®
MÓėŠĀÖĘĒāŃõ»ÆĶŠü×ĒŅŗ·“Ó¦µÄ»Æѧ·½³ĢŹ½________£®
(3)ÓėE¾ßÓŠĻąĶ¬¹ŁÄÜĶÅ£¬ĒŅ±½»·ÉĻÖ»ÓŠŅ»øöČ”“ś»łµÄĶ¬·ÖŅģ¹¹Ģ廹ӊ5ÖÖ£¬ĖüĆĒŹĒ£ŗ
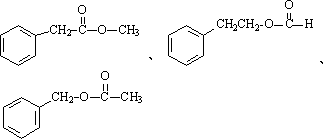
________”¢________£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2012-2013ѧğ¹ć¶«Ź”ÕŲĒģŹŠøßČżµŚ¶ž“Īøßæ¼Ä£ÄāĄķ×Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗ¼ĘĖćĢā
ŗĻ³É°±Č»ŗóŌŁÉś²śÄņĖŲŹĒ×īÖŲŅŖµÄ»Æ¹¤Éś²ś”£
I£®ŌŚ3øö2 LµÄĆܱÕČŻĘ÷ÖŠ£¬ŌŚĻąĶ¬µÄĪĀ¶ČĻĀ”¢Ź¹ÓĆĻąĶ¬µÄ“߻ƼĮ·Ö±š½ųŠŠ·“Ó¦£ŗ
3H2(g) + N2(g) 2NH3(g)£¬°“²»Ķ¬·½Ź½Ķ¶Čė·“Ó¦Īļ£¬±£³ÖŗćĪĀ”¢ŗćČŻ£¬²āµĆ·“Ó¦“ļµ½Ę½ŗāŹ±ÓŠ¹ŲŹż¾ŻČēĻĀ£ŗ
2NH3(g)£¬°“²»Ķ¬·½Ź½Ķ¶Čė·“Ó¦Īļ£¬±£³ÖŗćĪĀ”¢ŗćČŻ£¬²āµĆ·“Ó¦“ļµ½Ę½ŗāŹ±ÓŠ¹ŲŹż¾ŻČēĻĀ£ŗ
|
|
¼× |
ŅŅ |
±ū |
|
·“Ó¦ĪļĶ¶ČėĮæ |
3 mol H2Ӣ2 mol N2 |
6 mol H2Ӣ4mol N2 |
2 mol NH3 |
|
“ļµ½Ę½ŗāµÄŹ±¼ä/min |
|
5 |
8 |
|
Ę½ŗāŹ±N2µÄÅضČ/mol”¤L£1 |
c1 |
1.5 |
|
|
NH3µÄĢå»ż·ÖŹż |
¦Ų1 |
|
¦Ų3 |
|
»ģŗĻĘųĢåĆܶČ/g”¤L£1 |
¦Ń1 |
¦Ń2 |
|
£Ø1£©ČŻĘ÷ŅŅÖŠ·“Ó¦“ÓæŖŹ¼µ½“ļĘ½ŗāµÄ·“Ó¦ĖŁĀŹĪŖv(H2)=___________”£
£Ø2£©ŌŚøĆĪĀ¶ČĻĀ¼×ČŻĘ÷ÖŠ·“Ó¦µÄĘ½ŗā³£ŹżK= (ÓĆŗ¬c1µÄ“śŹżŹ½±ķŹ¾)”£
£Ø3£©·ÖĪöÉĻ±ķŹż¾Ż£¬ĻĀĮŠ¹ŲĻµÕżČ·µÄŹĒ________£ØĢīŠņŗÅ£©£ŗ
a£®2c1 > 1.5 b£®2¦Ń1 = ¦Ń2 c£®¦Ų3 = ¦Ų1
II£®¹¤ŅµÉĻÓĆ°±ĘųŗĻ³ÉÄņĖŲ£ØH2NCONH2£©µÄ·“Ó¦ŌŚ½ųŠŠŹ±·ÖĪŖČēĻĀĮ½²½£ŗ
µŚŅ»²½£ŗ2NH3(l)£«CO2(g) H2NCOONH4 (l) (°±»ł¼×Ėįļ§)
”÷H1
H2NCOONH4 (l) (°±»ł¼×Ėįļ§)
”÷H1
µŚ¶ž²½£ŗH2NCOONH4(l) H2O(l)£«H2NCONH2(l)
”÷H2
H2O(l)£«H2NCONH2(l)
”÷H2
£Ø4£©Ä³ŹµŃ銔×éÄ£Äā¹¤ŅµÉĻŗĻ³ÉÄņĖŲµÄĢõ¼ž£¬ŌŚŅ»Ģå»żĪŖ0.5 LĆܱÕČŻĘ÷ÖŠĶ¶Čė4 mol°±ŗĶ1mol¶žŃõ»ÆĢ¼£¬ŹµŃé²āµĆ·“Ó¦ÖŠø÷×é·ÖĖꏱ¼äµÄ±ä»ÆČē×óĻĀĶ¼IĖłŹ¾£ŗ

¢ŁŅŃÖŖ×Ü·“Ó¦µÄæģĀżÓÉĀżµÄŅ»²½¾ö¶Ø£¬ŌņŗĻ³ÉÄņĖŲ×Ü·“Ó¦µÄæģĀżÓɵŚ ²½·“Ó¦¾ö¶Ø”£
¢ŚµŚ¶ž²½·“Ó¦µÄĘ½ŗā³£ŹżKĖęĪĀ¶ČTµÄ±ä»ÆČēÓŅÉĻĶ¼IIĖłŹ¾£¬Ōņ”÷H2 0£»¢ŪČōµŚŅ»²½·“ӦɿĪĀŹ±°±ĘųÅضČŌö“ó£¬ĒėŌŚĶ¼IIÖŠ»³öµŚŅ»²½·“Ó¦K1ĖęĪĀ¶ČT±ä»ÆĒśĻߣ¬²¢×÷³ö±ŲŅŖµÄ±ź×¢”£
£Ø5£©°±ŗĶÄņĖŲČÜŅŗ¶¼æÉŅŌĪüŹÕĻõ¹¤ŅµĪ²ĘųÖŠµÄNO”¢NO2£¬½«Ęä×Ŗ»ÆĪŖN2”£
¢ŁÄņĖŲÓėNO”¢NO2ČżÕßµČĪļÖŹµÄĮæ·“Ó¦ĪŖ£ŗCO(NH2)2+NO+NO2 =CO2+2N2+2H2O
øĆ·“Ó¦ÖŠµÄŃõ»Æ¼ĮĪŖ £ØŠ“»ÆѧŹ½£©”£
¢ŚŅŃÖŖ£ŗN2(g)+O2(g)= 2NO(g) ”÷H =a kJ”¤mol£1
N2(g)+3H2(g)= 2NH3(g) ”÷H2=bkJ”¤ kJ”¤mol£1
2H2(g)+O2(g)= 2H2O(g) ”÷H = c kJ”¤mol£1
Ōņ4NH3(g) +4NO(g) +O2(g)= 4N2(g)+6H2O(g) ”÷H= ”£
¢ŪÄņĖŲČ¼ĮĻµē³Ų½į¹¹ČēĻĀĶ¼ĖłŹ¾”£Ę乤×÷Ź±øŗ¼«µē¼«·“Ó¦Ź½æɱķŹ¾ĪŖ ”£

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
AŗĶRŌŚŅ»¶ØĢõ¼žĻĀæÉŗĻ³É·¼Ļć×å»ÆŗĻĪļE£¬ŅŃÖŖAæÉŅŌŌŚŅ»¶ØĢõ¼žĻĀ×Ŗ»ÆĪŖG£¬ĒŅGŌŚ±ź×¼×“æöĻĀĆܶČĪŖ1.25 g/L”£ø÷ĪļÖŹ¼äĻą»„×Ŗ»Æ¹ŲĻµČēĻĀĶ¼ĖłŹ¾£ØijŠ©Ģõ¼žŅŃĀŌČ„£©”£

£Ø1£©AÖŠĖłŗ¬¹ŁÄÜĶŵÄĆū³ĘĪŖ””””””””””””””””””””£»¢ŁµÄ·“Ó¦ĄąŠĶĪŖ”””””””””””””£
£Ø2£©¢ŚµÄ»Æѧ·“Ó¦·½³ĢŹ½ĪŖ”””””””””””””””””””””””””””””””””””””£MÓėŠĀÖĘĒāŃõ»ÆĶŠü×ĒŅŗ·“Ó¦µÄ»Æѧ·½³ĢŹ½ ”£
£Ø3£©ÓėE¾ßÓŠĻąĶ¬¹ŁÄÜĶÅ£¬ĒŅ±½»·ÉĻÖ»ÓŠŅ»øöČ”“ś»łµÄĶ¬·ÖŅģ¹¹Ģ廹ӊ5ÖÖ£¬ĖüĆĒŹĒ£ŗ
 Ӣ
Ӣ  Ӣ
Ӣ 
_________ _Ӣ ӣ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
AŗĶRŌŚŅ»¶ØĢõ¼žĻĀæÉŗĻ³É·¼Ļć×å»ÆŗĻĪļE£¬ŅŃÖŖAæÉŅŌŌŚŅ»¶ØĢõ¼žĻĀ×Ŗ»ÆĪŖG£¬ĒŅGŌŚ±ź×¼×“æöĻĀĆܶČĪŖ1.25 g/L”£ø÷ĪļÖŹ¼äĻą»„×Ŗ»Æ¹ŲĻµČēĻĀĶ¼ĖłŹ¾(ijŠ©Ģõ¼žŅŃĀŌČ„)”£

Ķ¼5
£Ø1£©AÖŠĖłŗ¬¹ŁÄÜĶŵÄĆū³ĘĪŖ””””””””””””””””””””£»¢ŁµÄ·“Ó¦ĄąŠĶĪŖ”””””””””””””£
£Ø2£©¢ŚµÄ»Æѧ·“Ó¦·½³ĢŹ½ĪŖ”””””””””””””””””””””””””””””””””””””£
””””CÓėŠĀÖĘĒāŃõ»ÆĶŠü×ĒŅŗ·“Ó¦µÄ»Æѧ·½³ĢŹ½ ”£
£Ø3£©ÓėE¾ßÓŠĻąĶ¬¹ŁÄÜĶÅ£¬ĒŅ±½»·ÉĻÖ»ÓŠŅ»øöČ”“ś»łµÄĶ¬·ÖŅģ¹¹Ģ廹ӊ5ÖÖ£¬ĖüĆĒŹĒ£ŗ
 Ӣ
Ӣ  Ӣ
Ӣ 
_________ _Ӣ ӣ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com