
【题目】I.芦笋中的天冬酰胺(结构如下图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。
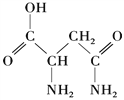
(1)硒、铬、锰元素中,________(填元素符号)元素基态原子核外未成对电子数最多。
(2)天冬酰胺中碳原子的杂化轨道类型有________种。
(3)已知NN的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,则N2中的________
键稳定(填“σ”或“π”)。
Ⅱ.胆矾CuSO45H2O可写成[Cu(H2O)4]SO4 H2O,其结构示意图如下:
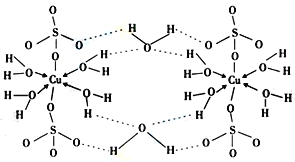
(4)下列说法正确的是_______(填字母)。
A.胆矾所含元素中,H、O、S的半径及电负性依次增大
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.加热条件下胆矾中的水会在相同温度下一同失去
(5)往硫酸铜溶液中加入过量氨水,溶液变为深蓝色,写出所发生反应的离子方程式__________________________;已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是______________________________________。
【答案】 Cr 2 π B Cu2+ + 4NH3 = [Cu(NH3)4]2+ N、F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F原子,使得N原子上的孤对电子难与Cu2+形成配位键
【解析】(1)硒、铬、锰三种元素的价电子排布式分别是4s24p4、3d54s1、3d54s2,所以Cr元素基态原子核外未成对电子数最多。(2)从结构中看碳原子形成的化学键的类型有单键和双键,碳原子中碳以sp3和sp2两种杂化。(3)三键中含有1个σ键和2个π键,则1个π键键能=(942 kJ·mol-1-247 kJ·mol-1)/2=347.5kJ·mol-1,所以N2中的π键稳定。(4)A.氧元素电负性大于硫,A错误;B.在上述结构示意图中,存在O→Cu配位键,H-O、S-O共价键和Cu、O离子键,B正确;C.胆矾是五水硫酸铜,胆矾是由水合铜离子及硫酸根离子构成的,属于离子晶体,C错误;D.由于胆矾晶体中水两类,一类是形成配体的水分子,一类是形成氢键的水分子,结合上有着不同,因此受热时也会因温度不同而得到不同的产物,D错误,答案选B。(5)铜离子能与氨气形成配位键,则氢氧化铜能溶解在氨水中,反应的离子方程式为Cu2+ + 4NH3=[Cu(NH3)4]2+;N、F、H三种元素的电负性:F>N>H,所以NH3中共用电子对偏向N,而在NF3中,共用电子对偏向F,偏离N原子,因此使得N原子上的孤对电子难与Cu2+形成配位键。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. —个苯环上已经连有-CH3、-CH2CH3、-OH三种基团,如果在苯环上再连接一个-CH3,其同分异构体有16种
B. 裂化汽油可用于萃取溴水中的溴
C. 除去乙醇中的少量水,方法是加入新制生石灰,经过滤后即得乙醇
D. 除去乙酸乙酯中的乙酸和乙醇杂质,可加入足量烧碱溶液,通过分液即得乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中,一定条件下发生反应:2A(g) +B(s)![]() 3C(?),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是
3C(?),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是
A. 改变压强对该平衡的移动一定无影响
B. 平衡体系中加入少量B,平衡向逆反应方向移动
C. 若正反应是吸热反应,则C为非气态
D. 若正反应是放热反应,则C为非气态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84”消毒液在日常生活中被广泛使用。该消毒液无色,PH大于7,对某些有色物质有漂白作用。你认为它可能的有效成分是(_______)
A. NaClO B. Na2CO3 C. KMnO4 D. SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. KOH的摩尔质量是56g
B. 一个碳原子的质量就是其相对原子质量
C. 硫原子的质量就是硫的相对原子质量
D. 摩尔质量的单位是g/mol时,氮气的摩尔质量在数值上等于它的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.所有的化学反应都有能量变化
B.需要加热的反应一定是吸热反应
C.所有的放热反应都可以在常温常压下自发进行
D.核能作为一种反应热,是理想的新能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃的水溶液中,AgCl、AgBr、AgI均难溶于水,且Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=1.0×10-12,Ksp(AgI)=8.7×10-17;
(1)若向AgBr的饱和溶液中加入少量的AgCl固体,则c(Br-)_______________。(填“增大”、“减小”或“不变”)。
(2)在25℃时,若取0.188g的AgBr(相对分子质量188)固体放入100mL水中(忽略溶液体积的变化),则溶液中Br-的物质的量浓度为_____________。
(3)①由上述Ksp判断,在上述(2)的体系中,能否实现AgBr向AgI的转化_______(填“能”或“否”),简述理由:_____________________________________________________________。
②若某KCl溶液的浓度为1.0×10-2mol·L-1,将等体积的该KCl溶液与AgNO3溶液混合,则生成沉淀所需AgNO3溶液的最小浓度为__________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com