
 某研究小组用NaOH溶液吸收尾气中的二氧化硫,将所得的Na2SO3溶液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴阳膜组合循环再生机理如图所示,
某研究小组用NaOH溶液吸收尾气中的二氧化硫,将所得的Na2SO3溶液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴阳膜组合循环再生机理如图所示,分析 ①从C为硫酸可知,b为阴离子交换膜.故a为阳离子交换膜.在阴极区应为水放电生成氢气和氢氧根,故A为氢氧化钠,E为氢气;
②阳极应为亚硫酸根放电生成硫酸根,写出即可.
解答 解:①从C为硫酸可知,硫酸根来源于亚硫酸根放电.故b为阴离子交换膜,a为阳离子交换膜,在阴极区应为水放电生成氢气和氢氧根离子,故A为氢氧化钠,E为氢气,
故答案为:阳;NaOH溶液;氢气;
②阳极应为亚硫酸根放电生成硫酸根,反应的离子方程式为SO32--2e-+H2O=2H++SO42-,
故答案为:SO32--2e-+H2O=2H++SO42-.
点评 本题考查了电解原理、电极方程式的书写等知识,注意知识的归纳和梳理是关键,难度中等.


科目:高中化学 来源: 题型:解答题
 某同学取一定量Fe 与Al 的混合物与一定量极稀的硝酸充分反应,已知硝酸的还原产物仅NH4NO3一种.在反应结束后的溶液中,逐滴加入4mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
某同学取一定量Fe 与Al 的混合物与一定量极稀的硝酸充分反应,已知硝酸的还原产物仅NH4NO3一种.在反应结束后的溶液中,逐滴加入4mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | B. | c(Na+)=2c(SO32-)+c(HSO3-) | ||
| C. | c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) | D. | c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 与
与 互为同分异构体
互为同分异构体 与
与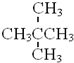 属于同系物
属于同系物 与
与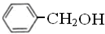 既不是同系物也不是同分异构体.
既不是同系物也不是同分异构体.| A. | ①⑤ | B. | ①④ | C. | ①③⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
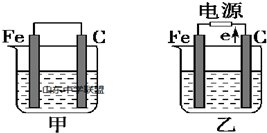
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 纯铁的腐蚀属于电化学腐蚀 | |
| B. | 钢铁吸氧腐蚀时,负极的电极反应式为Fe-3e-═Fe3﹢ | |
| C. | 海轮在浸水部位镶一些铜锭可起到抗腐蚀作用 | |
| D. | 在图示氧浓差腐蚀中,M极处发生的电极反应为O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学平衡原理是中学化学学习的重要内容.请回答下列问题:
化学平衡原理是中学化学学习的重要内容.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com