
| A. | 一定条件下2molSO2和1molO2充分反应后,混合气体的分子总数大于2NA | |
| B. | 常温常压下,64gO2和O3混合气体中含有原子总数为4NA | |
| C. | 1molCl2与NaOH溶液反应,转移的电子总数为2NA | |
| D. | 标准状况下,22.4LN2含共用电子对数为3NA |
分析 A、SO2和O2的反应是可逆反应,不能进行彻底;
B、根据O2和O3均由氧原子构成来分析;
C、氯气与氢氧化钠的反应为歧化反应,1mol氯气转移1mol电子;
D、1mol氮气含3mol共用电子对.
解答 解:A、SO2和O2的反应是可逆反应,不能进行彻底,故2molSO2和1molO2不能彻底反应生成2mol三氧化硫,故气体分子的个数大于2NA个,故A正确;
B、O2和O3均由氧原子构成,故64g混合气体中含有的氧原子的物质的量n=$\frac{64g}{16g/mol}$=4mol,故含有的氧原子的个数为4NA个,故B正确;
C、氯气与氢氧化钠的反应为歧化反应,1mol氯气转移1mol电子,即NA个,故C错误;
D、标况下,22.4L氮气的物质的量为1mol,而1mol氮气含3mol共用电子对,即3NA个,故D正确.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
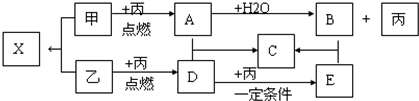
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
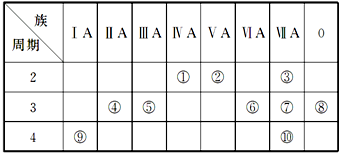
| A. | 有9个横行,分为7个周期 | B. | 有7个横行,分为7个周期 | ||
| C. | 有18个纵列,分为18个族 | D. | 有16个纵列,分为16个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:K>Na>Mg>N | B. | 酸性:HNO3>H3PO4>H2SiO3 | ||
| C. | 稳定性:HF<H2O<H2S | D. | 酸性:HClO4>H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 酸性锌锰干电池是以锌筒作为负极,并经汞齐化处理,使表面性质更为均匀,以减少锌的腐蚀.正极材料是由二氧化锰粉、氯化铵及碳黑组成的一个混合糊状物.正极材料中间插入一根碳棒,作为引出电流的导体.由于酸性锰锌干电池制作简单、价格便宜,在干电池市场占有很大份额,但是他也具有一些致命的缺点;存放时间缩短,放电后电压下降较快等,因此废酸性锌猛干电池的综合利用非常重要.上图是某小型化工厂处理废干电池的流程简单示意图:
酸性锌锰干电池是以锌筒作为负极,并经汞齐化处理,使表面性质更为均匀,以减少锌的腐蚀.正极材料是由二氧化锰粉、氯化铵及碳黑组成的一个混合糊状物.正极材料中间插入一根碳棒,作为引出电流的导体.由于酸性锰锌干电池制作简单、价格便宜,在干电池市场占有很大份额,但是他也具有一些致命的缺点;存放时间缩短,放电后电压下降较快等,因此废酸性锌猛干电池的综合利用非常重要.上图是某小型化工厂处理废干电池的流程简单示意图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
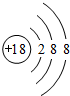 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式):OH-、H3O+.
;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式):OH-、H3O+. Fe(OH)3+3H+△H>0,平衡正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀.
Fe(OH)3+3H+△H>0,平衡正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com