
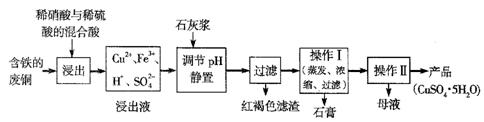
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 1 14 14 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g),其
2NH3(g),其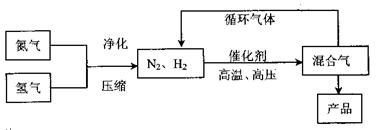
 2NH3(g)的△H= ;
2NH3(g)的△H= ;查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

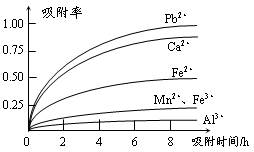
| 离子 | 离子半径(pm) | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
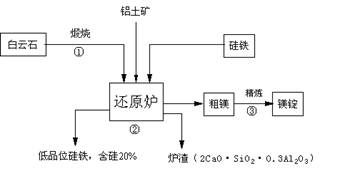
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用大量的SO2进行性质实验 |
| B.用双氧水代替KMnO4制O2 |
| C.用Cl2代替H2O2氧化FeSO4溶液 |
| D.用铜粉代替铜丝进行Cu和浓硫酸的反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.(1)(3)(5) | B.(2)(3)(4) | C.(1)(3)(4) | D.(1)(3)(4)(5) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.合成氨生产中将NH3液化分离,可加快正反应速率,提高H2的转化率 |
| B.硫酸工业中,接触室中热交换器是利用SO3转化为H2SO4时放出的热量 |
| C.氯碱工业采用离子交换膜法,可防止阳极室产生的Cl2进入阴极室 |
| D.钢铁发生吸氧腐蚀时,阴极的反应式为:Fe-2e→Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com