
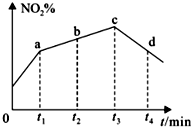
 研究氧化物与悬浮在大气中的海盐粒子的相互作用时,涉及如下反应:
研究氧化物与悬浮在大气中的海盐粒子的相互作用时,涉及如下反应:分析 (1)已知:①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g),
②2NO(g)+Cl2(g)?2ClNO(g),
根据盖斯定律①×2-②可得:4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g),则该反应平衡常数为①的平衡常数平方与②的商;
(2)若反应Ⅰ在绝热密闭容器中进行,2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K1 △H1<0,反应为放热反应,反应进行温度升高;
(3)可逆反应达到平衡状态,一定满足正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断;
(4)设 NO 和 Cl2 起始物质的量之比为 x,平衡时 Cl2 的转化率为 a,结合化学三行计算列式,依据平衡混合物中 ClNO 的体积分数为y,计算得到;
(5)0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,反应为2NO2+2NaOH═NaNO3+NaNO2+H2O,得到溶液中NaNO3物质的量浓度为0.mol/L,NaNO2物质的量为0.1mol/L,溶液B为0.1mol•L-1的CH3COONa溶液,已知HNO2的电离常数Ka=7.1×10-4mol•L-1,CH3COOH的电离常数Ka=1.7×10-5mol•L-1,说明CH3COOH酸性小于HNO2的酸性,对应阴离子水解程度大,以此来解答.
解答 解:(1)2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K1 △H<0 (I)
2NO(g)+Cl2(g)?2ClNO(g) K2 △H<0 (II)
根据盖斯定律,Ⅰ×2-Ⅱ可得:4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g),则该反应平衡常数K=$\frac{{{K}^{2}}_{1}}{{K}_{2}}$,
故答案为:$\frac{{{K}^{2}}_{1}}{{K}_{2}}$;
(2)若反应Ⅰ在绝热密闭容器中进行,2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K1 △H1<0,反应为放热反应,实验测得NO2( g )的转化率随时间变化的示意图中t3~t 4 时刻,NO2(g)的转化率 (NO2%)降低,因反应为放热反应且反应容器为绝热容器,随着反应的进行,体系的温度会升高,故再次达平衡时的转化率会降低,
故答案为:因反应为放热反应且反应容器为绝热容器,随着反应的进行,体系的温度会升高,故再次达平衡时的转化率会降低;
(3)2NO(g)+Cl2(g)?2ClNO(g) K2△H2<0,反应为气体体积减小的放热反应,
A.反应前后气体物质的量变化,容器内压强不再变化,说明反应达到平衡状态,故A正确;
B.n ( ClNO )=n ( NO )不能说明正逆反应速率相同,不能证明反应达到平衡状态,故B错误;
C.质量和体积不变,气体混合气体密度始终不变,不能说明反应达到平衡状态,故C错误;
D.反应速率之比等于化学方程式计量数之比,υ 正 ( NO )=υ 正 ( ClNO ),υ 正 ( NO )=υ 逆 ( ClNO )说明ClNO的正逆反应速率相同,故D正确;
故答案为:AD;
(4)设 NO 和 Cl2 起始物质的量之比为 x,平衡时 Cl2 的转化率为 a,
2NO(g)+Cl2(g)?2ClNO(g)
起始量(mol) x 1 0
变化量(mol) 2a a 2a
平衡量(mol) x-2a 1-a 2a
依据平衡混合物中 ClNO 的体积分数为y=$\frac{2a}{x+1-a}$,
故答案为:$\frac{2a}{x+1-a}$;
(5)0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,反应为2NO2+2NaOH═NaNO3+NaNO2+H2O,得到溶液A中NaNO3物质的量浓度为0.mol/L,NaNO2物质的量为0.1mol/L,溶液B为0.1mol•L-1的CH3COONa溶液,已知HNO2的电离常数Ka=7.1×10-4mol•L-1,CH3COOH的电离常数Ka=1.7×10-5mol•L-1,说明CH3COOH酸性小于HNO2的酸性,对应阴离子水解程度大,醋酸根离子和亚硝酸根离子水解,两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为:c(NO3-)>c(NO2-)>c(CH3COO-),
溶液B为0.1mol•L-1的CH3COONa溶液,常温下,向溶液 B 中加水稀释过程中,
a.稀释过程中氢氧根离子浓度减小,溶液中存在离子积常数,则氢离子浓度增大,$\frac{c({H}^{+})}{c(O{H}^{-})}$比值增大,故a正确;
b.加水稀释促进电离$\frac{c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$比值增大,故b正确;
c.溶液中加水稀释,钠离子浓度不变,醋酸根离子物质的量减小,$\frac{c(N{a}^{+})}{c(C{H}_{3}CO{O}^{-})}$,比值增大,故c正确;
d.$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$为电离平衡常数表达式,温度不变电离平衡常数不变,故d错误;
故答案为:c(NO3-)>c(NO2-)>c(CH3COO-); a、b、c.
点评 本题考查化学平衡计算,为高频考点,把握平衡三段法、平衡移动、电离平衡等为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol乙烷在光照条件下最多能与3 mol Cl2发生取代反应 | |
| B. | 石油裂解气能使溴的四氯化碳溶液、酸性KMnO4溶液褪色 | |
| C. | 水煤气可用来合成液态烃、甲醇等有机物 | |
| D. | 苯可通过取代反应制得硝基苯、氯苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
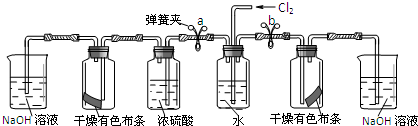
| 步骤 | 实验操作 | 预期现象和结论 |
| ① | 松开a处弹簧夹,夹上b处弹簧夹 | 装置左边集气瓶中的有色布条不褪色 删去,证明猜想一不正确. |
| ② | 松开b处弹簧夹,夹上a处弹簧夹 | 装置右边集气瓶中的有色布条褪色, 说明猜想二正确. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 | |
| B. | W与X形成的化合物中只含离子键 | |
| C. | X、Y、Z、W的原子半径依次减小 | |
| D. | 若W与Y原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
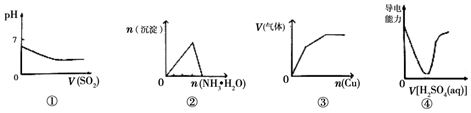
| A. | 图①表示将二氧化硫通入到一定量氯水中 | |
| B. | 图②表示将氨水滴入到一定量氯化铝溶液中 | |
| C. | 图③表示将过量铜粉加入到一定量浓硝酸中 | |
| D. | 图④表示将稀硫酸滴加到Ba(OH)2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com