
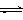 CH3OH(g)��H2O(g) ��H����49kJ/mol�����CO2��H2O (g)��Ũ����ʱ��仯��ͼ��ʾ��
CH3OH(g)��H2O(g) ��H����49kJ/mol�����CO2��H2O (g)��Ũ����ʱ��仯��ͼ��ʾ��
 �Ƹ�С״Ԫ�������������ϵ�д�
�Ƹ�С״Ԫ�������������ϵ�д� ����һ������ܼƻ�ϵ�д�
����һ������ܼƻ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
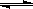 2Z��ӦӰ���ʾ��ͼ��ͼ���������ʾƽ����������Z���������������������ȷ���ǣ� ��
2Z��ӦӰ���ʾ��ͼ��ͼ���������ʾƽ����������Z���������������������ȷ���ǣ� ��
| A��X��Y��Z��Ϊ��̬ |
| B������ʱ�����������ܶȿ���Ϊ�˷�Ӧ�Ƿ�ﵽ��ѧƽ����ж����� |
C�������¶�ʱ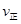 ���� ����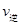 ��С��ƽ�������ƶ� ��С��ƽ�������ƶ� |
| D��ʹ�ô���Z�IJ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 p C��g�����ﵽƽ��ʱ�������¶Ȳ��䣬�������ݻ�ѹ����ԭ����һ�룬���ﵽ�µ�ƽ��ʱ��B��Ũ��Ϊԭ����2.5��������˵����ȷ���ǣ� ��
p C��g�����ﵽƽ��ʱ�������¶Ȳ��䣬�������ݻ�ѹ����ԭ����һ�룬���ﵽ�µ�ƽ��ʱ��B��Ũ��Ϊԭ����2.5��������˵����ȷ���ǣ� ��| A��ƽ��������Ӧ�����ƶ� | B������A��ת�������� |
| C�� m + n < p | D������C������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
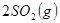
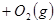

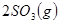 ��������ʼ�����ﵽ��ƽ�⣬��ʱ
��������ʼ�����ﵽ��ƽ�⣬��ʱ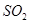 ��
��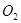 �����ʵ���֮��Ϊ2��1������ȡij�ִ�ʩ������
�����ʵ���֮��Ϊ2��1������ȡij�ִ�ʩ������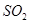 ��
��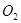 ��������һЩ�����ٴδﵽƽ�⣬����˵����ȷ����
��������һЩ�����ٴδﵽƽ�⣬����˵����ȷ����A����ƽ����ϵ�У�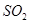 �� ��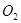 ���ʵ���֮����Ϊ2��1 ���ʵ���֮����Ϊ2��1 |
| B��ƽ��������Ӧ�����ƶ���ԭ��������Ӧ���������淴Ӧ���ʼ�С |
C����ƽ����ϵ���ƽ����ϵ�Ƚϣ�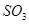 ��Ũ�ȿ϶����� ��Ũ�ȿ϶����� |
D��������ȡ�Ĵ�ʩ����С�������ݻ������¾�ƽ����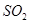 �� ��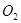 ��ת����֮�ȶ���1��1 ��ת����֮�ȶ���1��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 N2O4ƽ�⣬ƽ��ʱNO2��N2O4���ʵ���Ũ��֮��Ϊ�����������������£��ֱ��ٳ���NO2���ٳ���N2O4��ƽ�������𦵵ı仯��ȷ���ǣ��� ��
N2O4ƽ�⣬ƽ��ʱNO2��N2O4���ʵ���Ũ��֮��Ϊ�����������������£��ֱ��ٳ���NO2���ٳ���N2O4��ƽ�������𦵵ı仯��ȷ���ǣ��� ��| A������������ | B������NO2����������N2O4���𦵼�С |
| C�������𦵼�С | D������NO2���𦵼�С������N2O4�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 N2O4��g����H=-57.2kJ��mol-1
N2O4��g����H=-57.2kJ��mol-1
 ���ڡ�����С�����ڡ���
���ڡ�����С�����ڡ���| ʱ�䣨s�� | 0 | 20 | 40 | 60 | 80 |
| n��NO2��/mol | 0.40 | n1 | 0.26 | n3 | n 4 |
| n��N2O4��/mol | 0.00 | 0.05 | n 2 | 0.08 | 0.08 |
 ���䣬���м��ܼӿ�����Ӧ�����������NO2ת���ʵĴ�ʩ��
���䣬���м��ܼӿ�����Ӧ�����������NO2ת���ʵĴ�ʩ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2Z(g)��
2Z(g)��| A���ճ���ʱ����Ӧ����V (��)��С��V (��)���� |
| B���ﵽ��ƽ��ʱ�������������ƽ����Է����������� |
| C���ﵽ��ƽ��ʱ�������������ѹǿ��ԭ�������� |
| D���ﵽ��ƽ��ʱ������������İٷ���ɺ�ԭ����ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
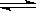 XC(g)������ͼ����ʾ��ϵ���ɴ��ƶ϶�ͼ������ȷ˵���ǣ� ��
XC(g)������ͼ����ʾ��ϵ���ɴ��ƶ϶�ͼ������ȷ˵���ǣ� ��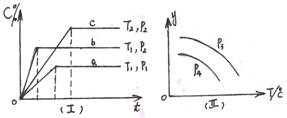

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 Z(g)����60s�ﵽƽ������0��3mol��Z������˵����ȷ����( )
Z(g)����60s�ﵽƽ������0��3mol��Z������˵����ȷ����( )| A��60 sʱZ��ƽ��Ũ��ΪO��03mol��L |
| B���������ݻ���Ϊ20 L,Z����ƽ��Ũ�Ƚ�����ԭƽ��Ũ�ȵ�һ�� |
| C�����¶Ⱥ�������䣬������������1 mol Y��Y��ת���ʽ����� |
| D���������¶ȣ�X�������������������Ӧ�ġ�H>O |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com