
| A、原电池中失去电子的一极一定为负极 |
| B、电解池中与直流电源负极相连的一极一定为阴极 |
| C、电解池中发生氧化反应的一极一定为阳极 |
| D、原电池中负极的质量一定减少 |


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
| A、钠在氯气中剧烈燃烧,生成黑烟 | ||||
| B、钠熔化成小球,与氯气缓慢反应,有蓝色火焰 | ||||
C、该反应的化学方程式为:Na+Cl
| ||||
| D、反应后,钠原子失去电子变成钠离子,氯原子得到电子变成氯离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液氨汽化时要吸收大量的热,可用作制冷剂 |
| B、生石灰能与水反应,可用干燥氯气 |
| C、维生素C受热易被氧化,所以有些新鲜蔬菜生吃较好 |
| D、氮气的化学性质不活泼,可用作粮食和食品仓库的保护气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
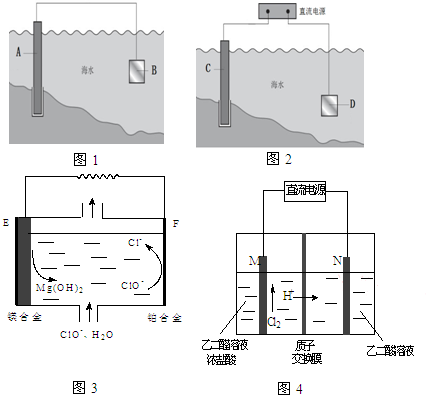 电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛.
电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:
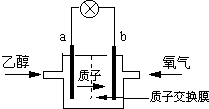 一种新型的乙醇电池,它用磺酸类质子溶剂.电池总反应为:C2H5OH+3O2→2CO2+3H2O,电池示意如图,下列说法正确的是( )
一种新型的乙醇电池,它用磺酸类质子溶剂.电池总反应为:C2H5OH+3O2→2CO2+3H2O,电池示意如图,下列说法正确的是( )| A、a极为电池的正极 |
| B、电池工作时电流由a极沿导线经灯泡再到b极 |
| C、电池负极的电极反应为:4H++O2+4e-=2H2O |
| D、电池工作时,1mol乙醇被氧化时就有12mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与乙醇反应时,NH5被氧化 |
| B、NH5中N元素的化合价为+5价 |
| C、1 mol NH5中含有5 molN-H键 |
| D、1 mol NH5与H2O完全反应,转移电子2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 CO和H2作为重要的燃料和化工原料,有着十分广泛的应用.
CO和H2作为重要的燃料和化工原料,有着十分广泛的应用.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com