
��ס��������º��ݵ��ܱ������У��ֱ����һ������A��B��������Ӧ��A(g)��B(g) 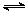 xC(g) ��H��0�������������c(A)��ʱ��t�ı仯��ͼ��ʾ��
xC(g) ��H��0�������������c(A)��ʱ��t�ı仯��ͼ��ʾ��
| ���� | �� | �� |
| �ݻ���L�� | 0.5 | 0.5 |
| ��Ӧ���ȣ�kJ�� | Q1 | Q2 |
| ��Ӧ����ʼ�� | 1 molA 1 molB | 0.5 molA 0.5 molB |
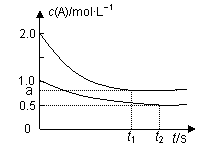
����˵����ȷ����
A��x=1 B��Q1��2Q2 C������������Ϣ������aֵ
D�����������������䣬��ʼʱ������������0.2 mol A��0.2 mol B��0.2 mol C�����ʱv(��)> v(��)
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���й��ڵ���ʵ�˵����ȷ����(����)
A��Һ̬HCl�����磬����HCl���ǵ����
B��NH3����ˮ�γɵ���Һ�ܵ��磬����NH3�ǵ����
C��SO2����ˮ�ܵ��磬����SO2�ǵ����
D��BaSO4��ˮ��Һ���ѵ��磬������״̬���ܵ��磬����BaSO4�ǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵����ȷ����
����A����������ͨ��ʯ����Һ�У���Һ�ȱ�죬����ɫ
����B��������������ͨ��Ư����Һ�еĻ�ѧ����ʽ��SO2+H2O+Ca(ClO)2==CaSO3��+2HClO
�� C������������Һʹ��ˮ��ɫ�����ӷ���ʽ��SO32��+H2O+Br2==SO42��+2H++2Br��
�� D������������Һ�м�����������ӷ���ʽ��SO32��+2H+== SO2��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����£����и���������ָ����Һ��һ���ܴ����������
A�������ӱ���ɫ����Һ��Na����Mg2+��SO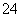 ��Cl��
��Cl��
B��0.1 mol��L��1 (NH4)2Fe(SO4)2��Һ�У�K+��Cu2+��Cl����MnO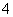
C��ʹ���ȱ��ɫ����Һ��NH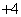 ��Cu2+��ClO����Cl��
��Cu2+��ClO����Cl��
D�� 0.1mol��L��1 NaHCO3��Һ��K����AlO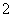 ��Cl����NO
��Cl����NO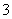
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
X��Y��M��N�Ƕ���������Ԫ�أ���ԭ����������������֪X�������������ǵ��Ӳ�����3����X��Mͬ���壬Y��ԭ���ڶ���������Ԫ����ԭ�Ӱ뾶�������˵����ȷ����
A��M��X�γɵĻ������Ӧ��ˮ����һ����ǿ��
B��Y2X��Y2X2�����������ӵĸ�������ͬ����ѧ������Ҳ��ȫ��ͬ
C��X��Y�ļ����Ӱ뾶��r��X2-��>r��Y+��
D��M����̬�⻯���N����̬�⻯���ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����ѣ�DME������Ϊ��21���͵����ȼ�ϡ����ɺϳ����Ʊ������ѵ���Ҫԭ�����£�
�� CO(g)+2H2(g)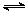 CH3OH(g) ��H 1=��90.7 kJ��mol-1
CH3OH(g) ��H 1=��90.7 kJ��mol-1
�� 2CH3OH(g)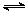 CH3OCH3(g)+H2O(g) ��H 2=��23.5 kJ��mol-1
CH3OCH3(g)+H2O(g) ��H 2=��23.5 kJ��mol-1
�� CO(g)+H2O(g)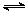 CO2(g)+H2(g) ��H 3=��41.2kJ��mol-1
CO2(g)+H2(g) ��H 3=��41.2kJ��mol-1
�ش��������⣺
��1����Ӧ3H2(g)��3CO(g)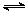 CH3OCH3(g)��CO2(g)�ġ�H�� kJ��mol-1��
CH3OCH3(g)��CO2(g)�ġ�H�� kJ��mol-1��
��2�����д�ʩ�У������CH3OCH3���ʵ��� ��
A��ʹ�ù�����CO B�������¶� C������ѹǿ
��3����Ӧ�������CH3OCH3�IJ��ʣ�ԭ���� ��
��4�����ϳ�����n(H2)/n(CO)=2ͨ��1 L�ķ�Ӧ���У�һ�������·�����Ӧ��
4H2(g)+2CO(g) 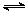 CH3OCH3(g)+H2O(g) ��H����CO��ƽ��ת�������¶ȡ�ѹǿ�仯��ϵ��ͼ1��ʾ������˵����ȷ���� ��
CH3OCH3(g)+H2O(g) ��H����CO��ƽ��ת�������¶ȡ�ѹǿ�仯��ϵ��ͼ1��ʾ������˵����ȷ���� ��
A����H <0 B��P1<P2<P3
C������P3��316��ʱ����ʼn(H2)/n(CO)=3����ﵽƽ��ʱ��COת����С��50��
��5������һ�����͵Ĵ�������Ҫ�ɷ���Cu-Mn�ĺϽ𣩣�����CO��H2�Ʊ������ѡ��۲�ͼ2�ش����⡣������n(Mn)/n(Cu)ԼΪ ʱ�������ڶ����ѵĺϳɡ�
��6��ͼ3Ϊ��ɫ��Դ��������ȼ�ϵ�ء��Ĺ���ԭ��ʾ��ͼ��a�缫�ĵ缫��ӦʽΪ ��
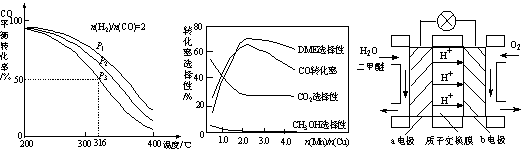 |
ͼ1 ͼ2 ͼ3
��7���״�Һ����ˮ���ƶ����ѵ�ԭ���ǣ�CH3OH +H2SO4��CH3HSO4+H2O��
CH3 HSO4+CH3OH��CH3OCH3+H2SO4����ϳ����Ʊ������ѱȽϣ��ù��յ��ŵ��Ƿ�Ӧ�¶ȵͣ�ת���ʸߣ���ȱ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵����,��ȷ����(����)
A.ʹ�÷�Һ©��ǰ�������Ƿ�©ˮ
B.����Һ�еμ�������������ɫ����,ԭ��Һһ������Cl-
C.���뱽��CCl4�Ļ����,���÷�Һ��
D.����NaCl��AgCl�Ļ����,���ù��˷�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ʵ������ƽ���ƶ�ԭ�����͵��ǣ� ��
| 2SO2+O2 ��ƽ����ϵ�У�������18O���ɵ���������SO2�е�18O�ĺ��������� |
|
|
| ||||||||||||||
| A | B | C | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͼ��ʾ�����ܱ������У�һ��װ��һ�����Ľ����ƣ�һ��װ��һ��������������ͬʱ���������������֣��ƺ�����������ȫ��Ӧ�ָ���ԭ�¶ȣ������ڿ����ijɷ��Բ��䡣���ƺ������������ʵ���֮����______��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com