
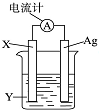
 依据氧化还原反应:2Ag++Cu═Cu2++2Ag设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag++Cu═Cu2++2Ag设计的原电池如图所示.请回答下列问题:分析 (1)根据电池反应式知,失电子化合价升高的金属作负极,不如负极活泼的金属或导电的非金属作正极,得电子的化合价降低的可溶性反应物作电解质溶液,据此设计原电池;
(2)原电池中,易失电子的电极铜为负极,银作正极,正极上得电子发生还原反应;
(3)电子从负极沿导线流向正极.
解答 解:(1)由反应“2Ag++Cu═Cu2++2Ag”可知,在反应中,Cu被氧化,失电子,应为原电池的负极,所以X电极材料是Cu,Ag+在正极上得电子被还原,电解质Y溶液为AgNO3 ,故答案为:Cu;AgNO3;
(2)正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,
故答案为:正;
(3)电子从负极Cu沿导线流向正极Ag,故答案为:Cu;Ag.
点评 本题考查了原电池设计,明确原电池原理是解本题关键,根据电池反应式中得失电子的物质选取负极材料和电解质,知道原电池中正负极的判断方法,难度不大.


科目:高中化学 来源: 题型:多选题
| A. | m+n<p | B. | 平衡向正反应方向移动 | ||
| C. | A的转化率降低 | D. | C的体积分数增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是HF、HCl、HBr、HI.
.共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是HF、HCl、HBr、HI.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 主族元素的原子核外电子最后填入的能级是s能级 | |
| B. | 主族元素的原子核外电子最后填入的能级是s能级或p能级 | |
| C. | 主族元素的最高正价等于主族的序数 | |
| D. | 主族元素的价电子数有可能超过最外层电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油不能和H2发生加成反应 | B. | 葡萄糖能发生氧化反应和水解反应 | ||
| C. | 淀粉水解的最终产物是葡萄糖 | D. | 蛋白质水解的最终产物为纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 维生素A是一种烯烃 | |
| B. | 维生素A的一个分子中有30个氢原子 | |
| C. | 维生素A的一个分子中有五个双键 | |
| D. | 维生素A能使溴水褪色,能被酸性KMnO4氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com