
分析 I.①该反应的化学平衡常数表达式:K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2}).c({O}_{2})}$;
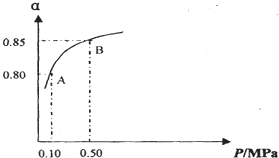
②反应达平衡后,体系总压强为0.10MPa,由图可知,SO2的平衡转化率α=0.80,利用三段式表示出平衡时反应混合物各组分的物质的量,再计算平衡时反应混合物各组分的平衡浓度,代入平衡常数表达式计算;
③化学平衡常数只与温度有关,温度不变,化学平衡常数不变;
④根据盖斯定律计算反应热;
II.(1)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
反应$\frac{①+②}{2}$可知CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g),1molCH4反应转移8mol电子;根据盖斯定律及物质的量与反应热的数值关系计算放出的热量;
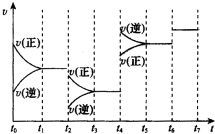
(2)根据图知,t2时改变条件,正逆反应速率都增大,且平衡正向移动,改变的条件为温度;
图中t4时正逆反应速率都增大,平衡逆向移动,改变的条件可能是压强;
t6时正逆反应速率都增大但仍然相等,平衡不移动,改变的条件是催化剂;要使CO的浓度最大,则平衡正向正反应方向移动而不向逆反应方向移动时.
解答 解:I.①该反应的化学平衡常数表达式:K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2}).c({O}_{2})}$,故答案为:K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2}).c({O}_{2})}$;
②由图象知,体系总压强为0.10MPa时SO2的平衡转化率为0.8,则
2SO2(g)+O2(g)$\frac{\underline{MnO_2}}{△}$2SO3(g)
起始:2.0mol 1.0mol 0
转化:1.6mol 0.8mol 1.6mol
平衡:0.4mol 0.2mol 1.6mol
则平衡时:c(SO2)=0.04mol/L,c(O2)=0.02mol/L,c(SO3)=0.16mol/L,
K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2}).c({O}_{2})}$=$\frac{0.16×0.16}{(0.04)^{2}×0.02}$=800,
故答案为:800;
③化学平衡常数只与温度有关,温度不变,化学平衡常数不变,A、B点温度相同,所以平衡常数K(A)=K(B),故答案为:=;
④①S(s)+O2(g)=SO2(g)△H1=-296 KJ•mol-1,②SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H2=-99 kJ•mol-1;
则利用盖斯定律将①×3+②×3可得3 S(s)+$\frac{9}{2}$O2(g)=3SO3(g)△H3=3×(△H1+△H2)=-1185 kJ•mol-1,
故答案为:-1185;
II.(1)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
反应$\frac{①+②}{2}$可知CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g),1molCH4反应转移8mol电子,4.48L甲烷的物质的量是0.2mol,0.2mol甲烷发生氧化反应时转移电子物质的量是1.6mol,转移电子数为1.6NA;
反应$\frac{①+②}{2}$可知CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ/mol,标准状况下4.48LCH4其物质的量为0.2mol,则放出的热量为0.2mol×867kJ=173.4kJ,
故答案为:1.6NA;173.4;
(2)根据图知,t2时改变条件,正逆反应速率都增大,且平衡正向移动,改变的条件为温度;
图中t4时正逆反应速率都增大,平衡逆向移动,该反应是反应前后气体体积增大的可逆反应,所以改变的条件可能是压强;
t6时正逆反应速率都增大但仍然相等,平衡不移动,改变的条件是催化剂;要使CO的浓度最大,则平衡正向正反应方向移动而不向逆反应方向移动时,则平衡混合物中CO的含量最高的一段时间是t3-t4,
故答案为:增大压强;t3-t4.
点评 本题考查化学平衡计算、化学平衡移动影响因素、盖斯定律有关计算等知识点,侧重考查学生分析计算能力,难点是根据改变条件时正逆反应速率变化及相对大小判断反应方向,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
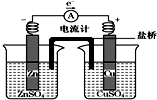
| A. | 盐桥是浸泡过KCl溶液的琼脂形成的,其中Cl-移向左池 | |
| B. | 铜片质量逐渐减少 | |
| C. | 电流从铜片经导线流向锌片 | |
| D. | 铜离子在铜片表面被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该固体粉末中一定不含有BaCl2 | |
| B. | 该固体粉末中一定含有KNO3 | |
| C. | 它的组成可能是CaCO3、BaCl2、CuSO4 | |
| D. | 它的组成一定是CaCO3、Na2SO4、KNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16gCH4含有10NA个电子 | |
| B. | 0.1mol•L-1的盐酸溶液中含有0.1NA个H+ | |
| C. | 1molNa与乙醇完全反应,失去2NA个电子 | |
| D. | 标准状况下,22.4L苯含有NA个苯分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com