
A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出).
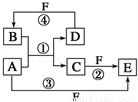
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为 ,反应④的化学方程式 .
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行.反应②也在水溶液中进行,其离子方程式是 ,已知光照条件下D与F方可以反应.
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为 .将标准状况下3.36L 物质E 与10.0g 氢氧化钠溶液充分反应,所得溶液溶质成分为 (写出化学式和对应的物质的量).
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年福建省高一上第二次月考化学试卷(解析版) 题型:选择题
下列离子方程式的写法正确的是
A.单质钠与水的反应:Na + H2O=Na+ + OH- + H2↑
B.氢气在氯气中燃烧:H2+ Cl2=2H++ 2Cl-
C.小苏打治疗胃酸过多:H+ + HCO3-=H2O + CO2↑
D.用氯化铁溶液腐蚀铜箔制造印刷电路板:Fe3++ Cu=Fe2++ Cu2+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古高二普通班上期中化学试卷(解析版) 题型:填空题
(1)不同温度下水的离子积的数据:25℃:1×10﹣14;t1:a; t2:1×10﹣12
试回答以下问题:
①若25<t1<t2,则a 1×10﹣14(填“>”、“<”或“=”),做此判断的理由是 .
②25℃时,某Na2SO4溶液中c(SO42﹣)=5×10﹣4mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH﹣)= .
③在t2温度下测得某溶液pH=7,该溶液显 (填“酸”、“碱”或“中”)性.
(2)在一定温度下,有:A.醋酸 B.硫酸 C.盐酸三种酸:
①当三种酸物质的量浓度相同时,三种溶液中水的电离程度由大到小的顺序是
(用a、b、c表示,下同)
②当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为 .
反应所需时间的长短关系是 .
③将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是 .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古高二普通班上期中化学试卷(解析版) 题型:选择题
某学生的实验报告所列出的下列数据中合理的是( )
A. 用10 mL量筒量取7.13mL稀盐酸
B. 用托盘天平称量25.20g NaCl
C. 用广泛pH试纸测得某溶液的pH为2.3
D. 用25 mL滴定管做中和滴定时,用去某浓度的碱溶液21.70 mL
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古高二普通班上期中化学试卷(解析版) 题型:选择题
用我们日常生活中的食用白醋(醋酸浓度约为1mol•L﹣1)进行下列实验,能证明醋酸为弱电解质的是( )
A.白醋中滴入石蕊试液呈红色
B.白醋加入豆浆中有沉淀产生
C.经检验白醋中c(H+)约为0.01 mol•L﹣1
D.蛋壳浸泡在白醋中有气体放出
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南师大附中高一下第一次段考化学试卷(解析版) 题型:选择题
R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)( )
A. 若R(OH)n为强碱,则W(OH)n+1也为强碱
B. 若HnXOm为强酸,则Y是活泼的非金属元素
C. 若Y的最低化合价为﹣2,则Z的最高正化合价为+7
D. 若X的最高正化合价为+5,则五种元素都是非金属元素
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二下4月月考化学试卷(解析版) 题型:填空题
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B﹣少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数.R是由A、D两元素形成的离子化合物,其中A+与D2﹣离子数之比为2:1.请回答下列问题:
(1)A元素形成的晶体属于A2密堆积型式,则其晶体内晶胞类型应属于 (填写“六方”、“面心立方”或“体心立方”).
(2)B﹣的价电子排布图为 ,在CB3分子中C元素原子的原子轨道发生的是 杂化.
(3)C的氢化物的空间构型为
(4)B元素的电负性 D元素的电负性(填“>”、“<”或“=”);用一个化学方程式说明B、D两元素形成的单质的氧化性强弱: .
(5)如图所示是R形成的晶体的晶胞,设晶胞的棱长为 a cm.试计算R晶体的密度为 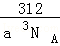 g/cm3 .(阿伏加德罗常数用 NA表示)
g/cm3 .(阿伏加德罗常数用 NA表示)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com