
分析 (1)根据n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$计算;
(2)①根据n=$\frac{V}{{V}_{m}}$计算二氧化碳的物质的量,结合O原子数目相等计算水的物质的量,再根据m=nM计算水的总质量;
②由化学式可知,Al3+、SO42-的物质的量之比为2:3,据此计算;
③根据质量守恒计算C的质量,再根据M=$\frac{m}{M}$计算C的摩尔质量.
解答 解:①n=$\frac{34g}{17g/mol}$=2mol,故答案为:2;
②N=nNA=2mol×NA/mol=2NA,故答案为:2;
③V=nVm=2mol×22.4L/mol=44.8L,故答案为:44.8.
(2)①标准状况下22.4LCO2的物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,与之含有氧原子数目相同的水的质量为$\frac{1mol×2}{1}$×18g/mol=36g;
故答案为:36;
②由化学式可知,Al3+、SO42-的物质的量之比为2:3,0.4mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是:0.4mol×$\frac{3}{2}$=0.6mol,
故答案为:0.6mol;
③根据质量守恒定律知,C的质量=(16+20-31.76)g=4.24g,C的摩尔质量=$\frac{4.24g}{0.04mol}$=106g/mol,故答案为:106g/mol.
点评 本题考查物质的量的相关计算,侧重于学生的分析能力和计算能力的考查,注意相关计算公式的运用,难度不大.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:选择题
| A. | 对烃基苯甲醛的结构简式: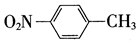 | B. | 质量数为37的氯原子:$\stackrel{37}{17}$Cl | ||
| C. | NH4Br的电子式: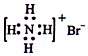 | D. | 二氧化碳分子的比例模型: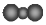 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 乙酸 | 1-丁醇 | 乙酸丁酯 | |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.3 |
| 密度/g•cm-3 | 1.05 | 0.81 | 0.88 |
| 水溶性 | 互溶 | 互溶 | 不溶 |
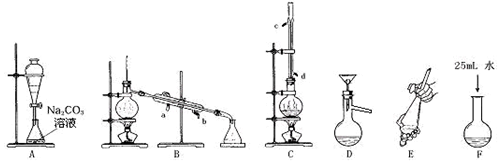
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量5.3 g Na2CO3固体溶于480 mL水配制成溶液 | |
| B. | 称量5.3 g Na2CO3固体溶于水配制成0.5 L溶液 | |
| C. | 称量5.3 g Na2CO3•10H2O晶体溶于水配制成0.5 L溶液 | |
| D. | 称量5.3 g Na2CO3•10H2O晶体溶于0.5 L水配制成溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
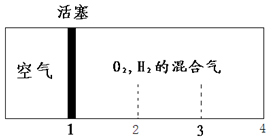 如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比可能为( )
如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比可能为( )| A. | 7:2 | B. | 5:4 | C. | 3:1 | D. | 2:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $→_{④}^{Na_{2}CO_{3}}$$→_{⑤}^{()}$滤液$→_{⑥}^{适量盐酸}$$→_{⑦}^{蒸发、结晶、烘干}$精盐
$→_{④}^{Na_{2}CO_{3}}$$→_{⑤}^{()}$滤液$→_{⑥}^{适量盐酸}$$→_{⑦}^{蒸发、结晶、烘干}$精盐 中填写所使用除杂试剂的化学式NaOH,在⑤中的操作名称是过滤.
中填写所使用除杂试剂的化学式NaOH,在⑤中的操作名称是过滤.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
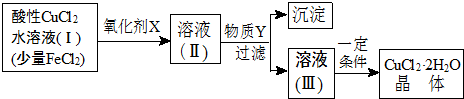
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com