
铝土矿(主要成分为Al2O3,还有少量杂质)是提取氧化铝的原料。提取氧化铝的工艺流程如下:
 |  | ||||||
 |  | ||||||
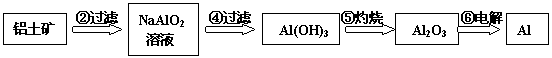 |
(1)请用离子方程式表示以上工艺流程中第①步反应:_______ _______。
(2)写出以上工艺流程中第③步反应的离子反应方程式:______ ___________。
(3)金属铝与氧化铁混合在高温下,会发生剧烈的反应。该反应的化学方程式_____________。列举此反应的一个用途_____________
(4)电解熔融氧化铝制取金属铝,若有0.9mol电子发生转移.理论上能得到金属铝的质量是________________。
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
某反应:A  B+C 在低温下不能自发进行,在高温下能自发进行,对该反应过程ΔH、ΔS的判断正确的是
B+C 在低温下不能自发进行,在高温下能自发进行,对该反应过程ΔH、ΔS的判断正确的是
A.ΔH<0、ΔS<0 B.ΔH>0、ΔS<0
C.ΔH<0、ΔS>0 D.ΔH>0、ΔS>0
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关 实验的叙述中,正确的是
实验的叙述中,正确的是
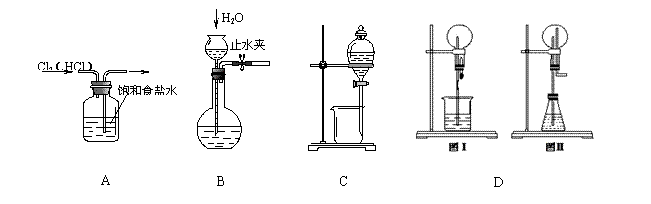
A. 图示除去Cl2中的HCl杂质,原因是饱和食盐水中大量的氯离子,同离子效应氯离子抑制了Cl2与水反应
B.图示检查装置气密性,关闭止水夹,从长颈漏斗上口注入水,到长颈漏斗球体水约1/2处,观察水位是否下降
C. 图示装置可以进行用酒精萃取溴水中的溴单质,溴单质在酒精中的溶解度大于在水中的溶解度
D. 图Ⅰ烧瓶中充满氨气,烧杯中盛装水,在图Ⅱ的锥形瓶中,加入足量的Cu与稀硝酸,图Ⅰ和图Ⅱ都产生喷泉现象且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
某盐的混合物中含有0.2 mol/L Na+、0.4 mol/L Mg2+、0.4 mol/L Clˉ,则SO42ˉ为( )
A.0.1 mol/L B.0.2 mol/L C.0.3 mol/L D.0.4 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
用已准确称量过的氯化钠固体配制1.00 mol·L-1的氯化钠溶液0.5 L,要用到的仪器是( )
①500 mL容量瓶 ②试管 ③烧瓶 ④胶头滴管 ⑤烧杯
⑥玻璃棒 ⑦托盘天平 ⑧药匙
A.①④⑤⑥⑦⑧ B.①②④⑤ C.①④⑤⑥ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
著名化学家徐光宪获得国家最高科学技术奖,以表彰他在稀土萃取理论方面作出的贡献。已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应。(注:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2。)下列说法正确的是( )
A.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI 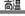 CeI4 + 2H2↑
CeI4 + 2H2↑
B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + 2Fe2+ == Ce3+ + 2Fe3+
C.金属Ce保存时,应该隔绝空气和水
D.铈的四种核素136 58Ce、138 58Ce、140 58Ce、142 58Ce,它们互称为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
对于中学某些常见离子的检验及结论一定正确的是( )
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸沉淀不消失,一定有SO42-
C.加入氯化钠溶液有白色沉淀产生,再加稀硝酸沉淀不消失,一定有Ag+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.加入过量氨水,有白色沉淀生成,则原溶液一定有Al3+
B.加入K3[Fe(CN)6]溶液,产生特征蓝色沉淀,则原溶液一定有Fe3+
C.加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则原溶液一定有SO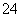
D.加入NaOH溶液,产生气体使湿润的红色石蕊试纸变蓝,则原溶液一定有NH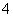
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com