
| A、20mL滴定管 | B、10mL量筒 | C、50mL量筒 | D、25mL滴定管 |
科目:高中化学 来源: 题型:
| ||
| ||
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度/g | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
| 162.5cV |
| m |
| 162.5cV |
| m |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组别 | ① | ② | ③ | ④ |
| 硫酸溶液的体积(mL) | 50 | 50 | 50 | 50 |
| 盐的质量(g) | 9.260 | 13.890 | 20.835 | 32.410 |
| 二氧化硫的体积(mL) | 1344 | 2016 | 3024 | 2464 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 反应温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 产品回收率(%) | 75.6 | 78.4 | 80.6 | 82.6 | 83.1 | 82.1 | 73.7 |
| 反应物料比 | 2:1 | 3:1 | 4:1 | 5:1 | 6:1 | 7:1 |
| 产品回收率(%) | 0 | 38.4 | 82.6 | 83.6 | 84.5 | 84.8 |
查看答案和解析>>
科目:高中化学 来源:知识精讲与能力训练 高三化学 题型:058
若要测定纯碱(可能含有NaHCO3杂质)的纯度,某同学进行了如下操作:
(1)用托盘天平称取W克纯碱样品
(2)溶于水配成250mL待测溶液
(3)准确移取20.00mL纯碱溶液注入锥形瓶中,并滴入几滴酚酞
(4)将酸式滴定管进行“必要处理”后,记下起始液面读数(V1 mL)
(5)进行滴定操作,并记下终点时滴定管内液面读数(V2 mL)
根据以上操作,回答下列问题:
(1)某同学记录了如下数据:W=11.44g V1=9.2mL,V2=17.2mL,上述记录数据中不确切的有________个.
(2)操作(3)所用的仪器是________(填字母代号).
(3)操作(4)中的“必要处理”是指________.
(4)判断操作(5)达到终点的依据是________.
(5)若标准液为盐酸,其物质的量浓度为C mol·L-1试用W、V1、V2、C表示纯碱的纯度_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
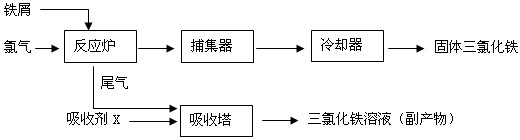
氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:

(1)取0.5mL三氯化铁溶液滴入50mL沸水中,再煮沸片刻得红褐色透明液体,![]() 该过程可用离子方程式表示为: ▲ 。
该过程可用离子方程式表示为: ▲ 。
(2)已知六水合氯化铁在水中的溶解度如下:
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液中获得FeCl3??6H2O的方法是: ▲ 。
(3)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)= ▲ mol/L(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
(4)吸收剂X是: ▲ ;吸收塔中吸收剂X的作用是: ▲ 。
(5)FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用cmol·L-1Na2S2O3溶液滴定(I2+2S2O32—=2I- +S4O62-),共用去VmL。则样品中氯化铁的质量分数为: ▲ 。
(6)用FeCl3溶液(32%~35![]() %)腐蚀印刷线路板的废液中含FeCl3、FeCl2和CuCl2。
%)腐蚀印刷线路板的废液中含FeCl3、FeCl2和CuCl2。
①若用电化学方法使废液再生。
阳极反应为:2Fe2+ – 2e- = 2Fe3+;
阴极反应为: ▲ 。
②若用化学方法,回收废液中铜的方法是(用反应式表示并简述操作要点):
▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com