(2013?江苏三模)氨和肼(N
2H
4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.
(1)工业上以甲烷为原料制取氢气用于合成氨.有关反应的热化学方程式如下:
CH
4(g)+2O
2(g)=CO
2(g)+2H
2O(g)△H=-846.3kJ?mol
-1CO(g)+O
2(g)=CO
2(g)△H=-282kJ?mol
-1H
2(g)+O
2(g)=H
2O(g)△H=-241.8kJ?mol
-1CH
4(g)与H
2O(g)反应生成CO(g)和H
2(g)的热化学方程式为
CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+161.1kJ?mol-1
CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+161.1kJ?mol-1
.
(2)氨气与二氧化碳反应可生成尿素[CO(NH
2)
2],该反应化学方程式为
2NH3+CO2?CO(NH2)2+H2O
2NH3+CO2?CO(NH2)2+H2O
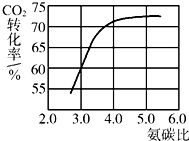
;反应中的氨碳比和二氧化碳转化率的关系如图所示,则氨碳比最好控制在
4.0
4.0
(填“3.0”或“4.0”)附近,理由是
氨碳比小于4.0时,CO2的转化率太低
氨碳比小于4.0时,CO2的转化率太低
.
(3)肼与亚硝酸反应可生成氮的另一种氢化物,在标准状况下,该氢化物气体的密度为1.92g?L
-1,且其中氮元素的质量分数为0.977,该氢化物受撞击后可完全分解为两种单质气体.该氢化物分解的化学方程式为
2HN3?3N2+H2
2HN3?3N2+H2
.
(4)以肼为原料的碱性燃料电池的电池反应为N
2H
4+O
2=N
2+2H
2O,放电时,负极的电极反应式为
N2H4+4OH--4e-═N2+4H2O
N2H4+4OH--4e-═N2+4H2O
.
(5)氨氧化法制硝酸工业尾气中的NO、NO
2气体可用氨水吸收,反应的化学方程式为:6NO+4NH
3=5N
2+6H
2O;6NO
2+8NH
3=7N
2+12H
2O.若尾气中的NO和NO
2共18mol被氨水完全吸收后,产生了15.6mol氮气,则此尾气中NO与NO
2的体积比为
9:1
9:1
.

 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案 (2013?江苏三模)氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.
(2013?江苏三模)氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.