
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g)在下列四种不同情况下化学反应速率最快的是( )
2C(g)+2D(g)在下列四种不同情况下化学反应速率最快的是( )
A.v(D)=0.45 mol/(Lmin)B.v(B)=0.01 mol/(Ls)
C.v(C)=0.40 mol/(Lmin)D.v(A)=0.15 mol/(Lmin)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】研究发现,反应CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
(1)CH4与Cl2反应时,每生成1molCCl4(g)或1molCHCl3(g)的焓变分别是△H1和△H2;H2在Cl2中燃烧,每生成1molHCl(g)产生的焓变为△H3,则:CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
(2)在密闭容器中,CCl4+H2![]() CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
实验序号 | 温度/℃ | 初始CCl4浓度/(mol·L-1) | 初始H2浓度/(mol·L-1) | CCl4的平衡转化率 |
1 | 110 | 0.8 | 1.2 | α1 |
2 | 110 | 1 | 1 | 50% |
3 | 100 | 1 | 1 | α3 |
①实验1中,CCl4的转化率α1_____50%(填“大于”“小于”或“等于”)。
②实验2中,反应进行到10h时达到平衡,在这10h内,H2的平均反应速率为_____mol· L-1·min-1。
③110 ℃时,该反应的化学平衡常数的数值为________。
④实验3中,α3的值________。
A. 等于50% B.大于50% C.小于50% D.依题所给信息无法判断
(3)120 ℃时,分别进行H
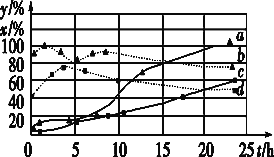
①图中表示H2起始浓度为2mol·L-1CHCl3的百分含量的变化曲线是____(填字母)。
②依图可知,有利于提高CCl4的消耗百分率和产物中CHCl3的百分含量H2的起始浓度应该为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式_______________。
(2)在2L恒容密闭器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
①结合表中数据,判断该反应的△H____0(填“>”或“<”),理由是_________。
②判断该反应达到平衡的依据是_______。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)= v逆(N2)
(3)700℃时,若向2L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)![]() C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
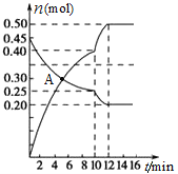
①0~10 min内的CO2平均反应速率v=____________。
②图中A点v(正)___v(逆)(填“>”、“<”或“=”)。
③第10 min时,外界改变的条件可能是_____________。
A.加催化剂 B.增大C的物质的量
C.减小CO2的物质的量 D.升温 E.降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(选用)CuI是一种不溶于水的白色固体,它可以由反应:2Cu2++4I-=2CuI↓+I2 而得到。如图所示装置中,a、b都是惰性电极,通电一段时间后,在KI一淀粉溶液中阳极周围变蓝色,则下列说法正确的是

A.若a极变红,则在Pt电极上:2I--2e-=I2碘遇淀粉变蓝
B.若b极变红,在Pt电极上:4OH--4e-=2H2O+O2,O2将I-氧化为I2,碘遇淀粉变蓝
C.若a极变红,在Cu电极上:开始Cu+I--e-=CuI,一段时间后2I--2e-=I2,碘遇淀粉变蓝
D.若b极变红,在Cu极上:Cu-2e-=Cu2+,Cu2+显蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈(Ce)是镧系金属元素。空气污染物NO通常用含Ce4+的溶液吸收,生成HNO2、NO3ˉ,再利用电解法将上述吸收液中的HNO2转化为无毒物质,同时生成Ce4+,其原理如图所示。下列说法正确的是
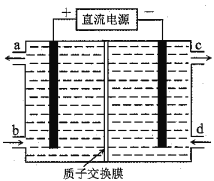
A. H+由右室进入左室
B. Ce4+从电解槽的c口流出,且可循环使用
C. 阴极的电极反应式:2HNO2+6H++6eˉ=N2↑+4H2O
D. 若用甲烷燃料电池作为电源,当消耗标准状况下33.6L甲烷时,理论上可转化HNO22mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制H2O2过程中,先用电解NH4HSO4(以昂贵的铂作电极)得到过二硫酸。
阳极:2HSO4- ![]() H2S2O8+2e-
H2S2O8+2e-
阴极:2H3O++2e-→H2↑+2H2O
然后过二硫酸水解,最后可以制得H2O2。第一步水解 H2S2O8+H2O—→H2SO4+H2SO5 第二步水解 H2SO5+H2O—→H2SO4+H2O2,则要制得1mol H2O2,电解时转移电子数为( )
A.0.5molB.1molC.1.5molD.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积固定为3L的某密闭容器中加入1mol A、2mol B,一定温度下发生如下发应:A(s)+2B(g)![]() C(g)+D(g),经反应5 min后,测得C的浓度为0.3mol·L-1 。则下列说法正确的是
C(g)+D(g),经反应5 min后,测得C的浓度为0.3mol·L-1 。则下列说法正确的是
A. 5 min 内D的平均反应速率为0.02 mol·L-1·min-1
B. 第5min时C的反应速率为0.06 mol·L-1·min-1
C. 经5min后,向容器内再加入A,正反应速率变大
D. 平衡状态时,生成1molD时同时生成1molA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,氢离子浓度都为1×10-2 mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入003 g Zn粉,在相同条件下充分反应,下列有关叙述正确的是
A. 稀释2倍后,两溶液的pH:盐酸小于醋酸
B. 盐酸和醋酸分别与Zn反应放出的氢气一样多
C. 盐酸和醋酸分别与Zn反应的速率一样大
D. 稀释2倍前,醋酸溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液有许多奇妙之处,你只有深入的去思考,才能体会到它的乐趣。下列关于电解质溶液的叙述中正确的是( )
A.浓度相同的![]() 、
、![]() 两种盐溶液中,所有阴离子总浓度后者大
两种盐溶液中,所有阴离子总浓度后者大
B.常温下,1![]() 的
的![]() 溶液与1
溶液与1![]() 的NaOH溶液混合后,所得混合液中:
的NaOH溶液混合后,所得混合液中:![]()
C.物质的量浓度相同的![]() 和
和![]() 两种溶液中,
两种溶液中,![]() 前者小于后者
前者小于后者
D.常温下,某溶液中由水电离出的![]() ,则此溶液可能是盐酸
,则此溶液可能是盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com