
【题目】有两份溶液,其中所含溶质相同,设其摩尔质量为M g/mol。根据下表信息,回答有关问题:
项目 | 溶质的质量分数 | 溶液的密度/(g·cm-3) |
第一份溶液 | ω1 | ρ1 |
第二份溶液 | ω2 | ρ2 |
(1)第一份溶液中,溶质的物质的量浓度为_______。
(2)取等质量两份溶液混合,则所得混合液中溶质的质量分数ω3=_____。
(3)若有ω1>ω2,取等体积的两份溶液混合,设所得混合液中溶质的质量分数为ω4,试比较ω3、ω4的相对大小____;___。
【答案】![]() mol·L-1
mol·L-1 ![]() 若ρ1>ρ2,ω3<ω4 若ρ1<ρ2,ω3>ω4
若ρ1>ρ2,ω3<ω4 若ρ1<ρ2,ω3>ω4
【解析】
(1)利用物质的量浓度=![]() 进行计算;
进行计算;
(2)利用溶质质量分数的计算公式,分别计算出溶质的量与溶剂的量进行计算即可;
(3)此题是一道讨论题,解题时计算出ω4的表达式与ω3比较,结合数学上关于比较大小的方法解决即可。
设其溶液的体积为1L及溶质的质量为m1,其物质的量为n1,其浓度为C1。而已知其溶质的质量分数为ω1,溶液的密度(g/cm3)为ρ1。则
(1)第一份溶液中,溶质的物质的量浓度为:m1=ρ1×V×W1×1000,n1=![]() 即 C1=
即 C1=![]() =
=![]() =
=![]() mol·L-1;
mol·L-1;
(2)设 两份溶液中所含的溶质分别为M1,M2。有M1=m×ω1,M2=m×ω2,ω3=![]() ×100%=(
×100%=(![]() )×100%。取等质量两份溶液混合,则所得混合液中溶质的质量分数(
)×100%。取等质量两份溶液混合,则所得混合液中溶质的质量分数(![]() )×100%;
)×100%;
(3)取等体积的两份溶液混合,则设其体积为V。则溶液的质量分别为M3、M4。有
那么其溶质的质量分别为m3、m4。ω4=![]() ×100%=
×100%=![]() 则
则![]() =
=![]() +
+![]() 。因为ω1>ω2由 则若ρ1>ρ2,则ω4>ω3。若ρ1<ρ2,则ω3>ω4。
。因为ω1>ω2由 则若ρ1>ρ2,则ω4>ω3。若ρ1<ρ2,则ω3>ω4。


 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】甲、乙两种有机物的球棍模型如下,下列有关二者的描述中正确的是( )
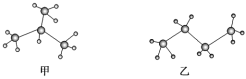
A.甲、乙为同一物质
B.甲、乙互为同分异构体
C.甲、乙一氯取代物的数目不同
D.甲、乙分子中含有的共价键数目不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在城市中地下常埋有纵横交错的管道和输电线路,有些地面上还铺有地铁或城铁的铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道或铁轨形成回路时,就会引起后者的腐蚀。原理简化如图所示。则下列有关说法不正确的是
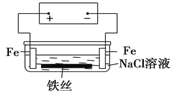
A.原理图可理解为两个串联电解装置
B.溶液中铁丝被腐蚀时,左侧有无色气体产生,附近产生少量白色沉淀,随后变为灰绿色
C.溶液中铁丝左端电极反应式为:Fe-2e-=Fe2+
D.地下管线被腐蚀,不易发现,维修也不便,故应将埋在地下的金属管道表面涂绝缘膜(或油漆等)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二钴主要用作颜料、釉料及磁性材料,利用铜钴矿石制备Co2O3的工艺流程如图所示。
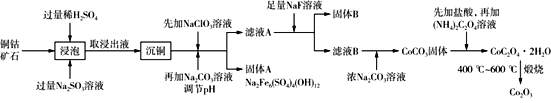
已知:铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。请回答下列问题:
(1)“浸泡”过程中可以加快反应速率和提高原料利用率的方法是_______(写出2种即可)。
(2)“浸泡”过程中,加入Na2SO3溶液的主要作用是____________。
(3)向“沉铜”后的滤液中加入NaClO3溶液,写出滤液中的金属离子与NaClO3反应的离子方程式________________。
(4)温度、pH对铜、钴浸出率的影响如图1、图2所示:
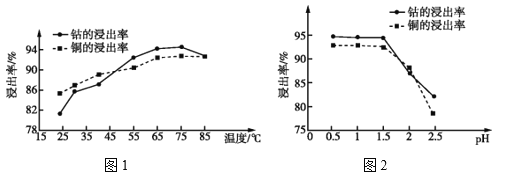
①“浸泡”铜钴矿石的适宜条件为__________________。
②图2中pH增大时铜、钴浸出率下降的原因可能是___________。
(5)CoC2O4·2H2O在空气中高温煅烧得到Co2O3的化学方程式是________。
(6)一定温度下,向滤液A中加入足量的NaF溶液可将Ca2+、Mg2+沉淀而除去,若所得滤液B中c(Mg2+)=1.0×10-5 mol/L,则滤液B中c(Ca2+)为______。[已知该温度下Ksp(CaF2)=3.4×10-11,Ksp(MgF2)=7.1×10-11]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL某混合液中,硝酸和硫酸的物质量浓度分别是0.4mol·L-1,0.1mol·L-1,向该混合液中加入1.92g铜粉,加热,待充分反应后,所得溶液中铜离子物质量浓度是( )
A.0.15 mol·L-1B.0.225 mol·L-1C.0.35 mol·L-1D.0.45 mol·L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态,将KOH溶液滴入亚砷酸溶液,各种微粒物质的量分数与溶液的pH关系如图所示。下列说法正确的( )

A.人体血液的pH在7.35~7.45之间,用药后人体中含As元素的主要微粒是AsO33-
B.n(H3AsO3)∶n(H2AsO3-)=1∶1时,溶液显酸性
C.当pH调至11时发生反应的离子方程式是H3AsO3+OH-=H2AsO3-+H2O
D.pH=12时,溶液中c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物。由此可知,下列说法正确的是( )
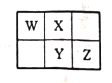
A.X形成的单核阴离子的还原性大于Y形成的单核阴离子的还原性
B.Y、Z的氧化物对应水化物的酸性一定是Y的强于Z的
C.X、Y、Z的最简单氢化物中稳定性最弱的是Y的氢化物
D.Z的单质在化学反应中只能表现出氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是重要的有机物,可由E和F在一定条件下合成(部分反应物或产物省略,另请注意箭头的指向):
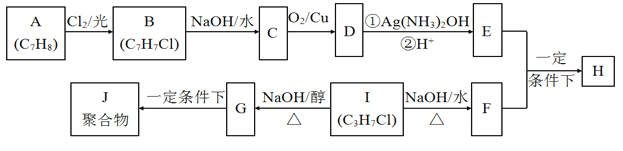
已知以下信息:
i.A属于芳香烃,H属于酯类化合物;
ii.I的核磁共振氢谱有两组峰,且峰的面积比为6:1。
回答下列问题:
(1)E的含氧官能团名称为____________________,B的结构简式为___________________。
(2)B→C和G→J两步的反应类型____________________;_______________________。
(3)①E+F→H的化学方程式:_________________________________。
②D与银氨溶液反应的化学方程式:___________________________。
(4)I的同系物K比I相对分子质量大28,K有多种同分异构体。
①K的同分异构体共_______________种。
②若K不能发生消去反应,则K的结构简式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数逐渐增大,四种元素形成的化合物甲的结构如图所示:
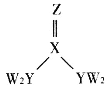
且W与X、Y、Z均可形成电子数相等的分子,W2Z常温常压下为液体。下列说法正确的是
A.YW3分子中的键角为120°
B.W2Z的稳定性大于YW3
C.物质甲分子中存在6个σ键
D.Y元素的氧化物对应的水化物为强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com