
50mL 4mol•L﹣1的NaOH溶液密度为1.6g•cm﹣3,则
(1)此溶液的质量分数是 .
(2)此溶液加水稀释至500mL,再取出50mL,则此50mL溶液的物质的量浓度变是 所含溶质的质量是 g.
(3)此溶液能吸收标准状况下的Cl2的体积是 ,生成NaCl的质量是 .
考点: 物质的量浓度的相关计算;化学方程式的有关计算;溶液中溶质的质量分数及相关计算.
分析: (1)根据c=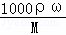 的变形公式计算出 此溶液的质量分数;
的变形公式计算出 此溶液的质量分数;
(2)根据稀释过程中溶质的物质的量不变计算出稀释后溶液的浓度,溶液为均一的,则可知取出的50mL溶液浓度,根据m=cVM计算出所含溶质的质量;
(3)根据n=cV计算出NaOH的物质的量,再根据反应方程式计算出需要氯气的体积及生成氯化钠的质量.
解答: 解:(1)根据c=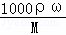 可知,ω=
可知,ω=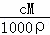 =
=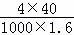 =10%,
=10%,
故答案为:10%;
(2)此溶液加水稀释至500mL,稀释后溶液浓度为:c=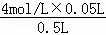 =0.4mol/L,溶液具有均一性,则取出的50mL溶液的浓度为0.4mol/L,取出的稀释后的50mL该溶液中含有氢氧化钠的物质的量为:0.4mol/L×0.05L=0.02mol,氢氧化钠的质量为:40g/mol×0.02mol=0.8g,
=0.4mol/L,溶液具有均一性,则取出的50mL溶液的浓度为0.4mol/L,取出的稀释后的50mL该溶液中含有氢氧化钠的物质的量为:0.4mol/L×0.05L=0.02mol,氢氧化钠的质量为:40g/mol×0.02mol=0.8g,
故答案为:0.4mol/L;0.8g;
(3)50mL 4mol•L﹣1的NaOH溶液中含有氢氧化钠的物质的量为:4mol/L×0.05L=0.2mol,
氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O,则
Cl2 +2NaOH=NaCl+NaClO+H2O
22.4L 2mol 58.5g
V 0.2mol m
则需要标况下氯气的体积为:V=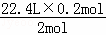 =2.24L,
=2.24L,
生成氯化钠的质量为:m=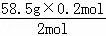 =5.85g,
=5.85g,
故答案为:2.24L;5.85g.
点评: 本题考查了有关化学方程式的计算、物质的量浓度的计算等知识,题目难度中等,试题知识点较多、计算量稍大,充分考查学生的分析、理解能力及化学计算能力.


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
工业上可利用合成气(CO和H2的混合气体)生产甲醇.已知:CO(g)+2H2(g)⇌CH3OH(g)△H=﹣92.9kJ/mol一定条件下,该反应在一体积固定的密闭容器中达到平衡.下列说法正确的是()
A. 该反应的△S<0
B. 该反应在任何温度下均能自发进行
C. 向容器中充入少量He,平衡向正反应方向移动
D. 升高温度平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
1 L水中溶有Mg(HCO3)2和CaCl2的浓度分别是b mol·L-1和2b mol·L-1,现用一种试剂(适量)把Ca2+、Mg2+除去,这种试剂最好选用 ( )。
A.Ca(OH)2 B.NaOH
C.NaHCO3 D.Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
据实验证明:用漂白粉溶液浸泡过的有色布条,如果晾置在空气中,过了一段时间,其漂白效果会更好,原因可能是()
A. 漂白粉被氧化了
B. 有色布条被空气中的氧气氧化了
C. 漂白粉溶液跟空气中的CO2反应充分,生成了较多量的HClO
D. 漂白粉溶液蒸发掉部分水,其浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中含有原子数由多到少排列正确的是()
①0.1mol H2SO4 ②4.8g氢气 ③5.6L标准状况下NH3 ④4℃时5.4mL H2O.
A. ①>②>③>④ B. ②>③>④>① C. ②>①>③>④ D. ③>①>④>②
查看答案和解析>>
科目:高中化学 来源: 题型:
C、N、S都是重要的非金属元素.下列说法正确的是()
A. 三者对应的氧化物均为酸性氧化物
B. 三者的单质直接与氧气反应都能至少生成两种氧化物
C. 相同温度下,等物质的量浓度的Na 2CO3、NaNO3、Na2SO3溶液的pH大小顺序:NaNO3<Na2S03<Na2CO3
2CO3、NaNO3、Na2SO3溶液的pH大小顺序:NaNO3<Na2S03<Na2CO3
D. CO2、NO2、SO2都能与H2O反应,其反应原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
“类推”的思维方式在化学学习与研究中经常采用,但有时会产生错误结论.下列类推结论中,正确的是()
A. 由氢氟酸刻蚀玻璃可推知盐酸也能用来刻蚀玻璃
B. 由Na2O中阴阳离子个数比为1:2,可推出Na2O2中阴阳离子个数比为 1:1
C. 由钠与冷水剧烈反应,可推知钾也能与冷水剧烈反应
D. 由“2Fe+3Br2═2FeBr3”反应可推出“2Fe+3I2═2FeI3”反应也能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
将Fe(OH)3胶体与BaCl2的混合液装在半透膜中,浸泡在装有蒸馏水的烧杯中,过一段时间后,取烧杯中液体进行实验,能证明半透膜有破损的是()
A. 溶液为黄色
B. 能产生丁达尔效应
C. 加入AgNO3 溶液产生白色沉淀
D. 加入Na2SO4 溶液产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组探究SO2气体还原Fe,I2,他们使用的药品和装置如如所示.
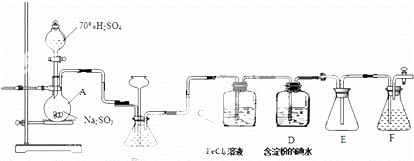
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若 ,则整个装置气密性良好.装置E的作用是 .装置F中为NaOH溶液.
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 .
a.蒸馏水
b.饱和Na2SO3溶液
c.饱和NaHSO3溶液
d.饱和NaHCO3溶液
(3)SO2气体还原Fe3+反应的产物是 (填离子符号).
(4)在上述装置中通入过量的SO2为了验证C中SO2与Fe3+发生了氧化还原反应,他们取C中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去.
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀.
上述方案不合理的是方案①,原因是 .
(5)能表明I﹣的还原性弱于SO2的现象是 ,写出有关离子方程式: ﹣.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com