
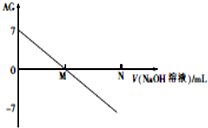
 为了更好地表示溶液的酸碱性,科学家提出了酸度(aciditygrade)的概念,定义AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$,室温下用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1 醋酸,滴定结果如图所示,下列有关叙述不正确的是( )
为了更好地表示溶液的酸碱性,科学家提出了酸度(aciditygrade)的概念,定义AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$,室温下用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1 醋酸,滴定结果如图所示,下列有关叙述不正确的是( )| A. | 室温下,醋酸的电离平衡常数约为10-6 | |
| B. | M点加入NaOH溶液的体积大于20.00mL | |
| C. | M点时溶液中:c(CH3COO-)=c(Na+) | |
| D. | 若N点时加入NaOH溶液的体积为40mL,则N点时溶液中:c(Na+)=2[c(CH3COO-)+c(CH3COOH)] |
分析 A.室温下,醋酸的AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$=7,结合水的离子积K=c(H+)•c(OH-)来计算;
B.M点的AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$=0,即$\frac{c({H}^{+})}{c(O{H}^{-})}$=1,即c(H+)=c(OH-),溶液显中性;
C.根据电荷守恒分析;
D.根据物料守恒分析.
解答 解:A.室温下,醋酸的AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$=7,即$\frac{c({H}^{+})}{c(O{H}^{-})}$=107,而水的离子积K=c(H+)•c(OH-)=10-14,两式联立可知:c(H+)=10-3.5,而在醋酸溶液中,c(CH3COO-)≈c(H+)=10-3.5,故电离平衡常数K=$\frac{C(C{H}_{3}CO{O}^{-})•C({H}^{+})}{C(C{H}_{3}COOH)}$=$\frac{1{0}^{-3.5}×1{0}^{-3.5}}{0.01}$=10-5,故A错误;
B.M点的AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$=0,即$\frac{c({H}^{+})}{c(O{H}^{-})}$=1,即c(H+)=c(OH-),溶液显中性,而当加入氢氧化钠溶液20mL时,恰好和醋酸完全中和,得到醋酸钠溶液,溶液显碱性,所以NaOH的体积小于20mL,故B错误;
C.M点的AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$=0,即$\frac{c({H}^{+})}{c(O{H}^{-})}$=1,即c(H+)=c(OH-),溶液中电荷守恒为:c(H+)+c(Na+)=c(CH3COO-)+c(OH-),所以c(CH3COO-)=c(Na+),故C正确;
D.当N点加入NaOH溶液为40mL时,所得的为等浓度的CH3COONa和NaOH的混合溶液,根据物料守恒可知:c(Na+)=2[c(CH3COO-)+c(CH3COOH)],故D正确;
故选AB.
点评 本题考查了酸碱中和滴定的过程中平衡常数的计算以及三个守恒的运用,题目难度中等,注意离子浓度随着溶液体积的改变而发生的变化,注意把握题干中的信息.


科目:高中化学 来源: 题型:填空题
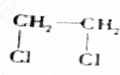 +2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaCl;
+2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaCl;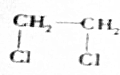 +2NaOH$→_{△}^{乙醇}$CH≡CH↑+2NaCl+2H2O;
+2NaOH$→_{△}^{乙醇}$CH≡CH↑+2NaCl+2H2O;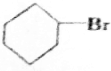 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$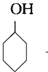 +NaBr;
+NaBr;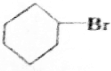 +NaOH$→_{△}^{C_{2}H_{5}OH}$
+NaOH$→_{△}^{C_{2}H_{5}OH}$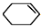 +H2O+NaBr.
+H2O+NaBr.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


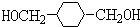 .
.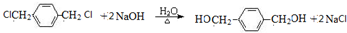 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
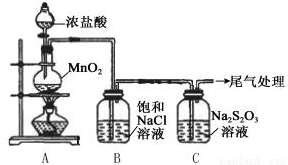
| 操作 | 现象 |
| 打开分液漏斗活塞,滴加一定量浓盐酸,加热 | i.A中有黄绿色气体生成,C中液面上方有白雾,溶液中开始出现少量浑浊; ii.一段时间后,C中产生大量黄色沉淀. |
| 用湿润的淀粉碘化钾试纸检验C中白雾 | 淀粉碘化钾试纸变蓝 |
| C中浊液过滤后,取少量滤液用盐酸酸化,滴加氯化钡溶液 | 有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
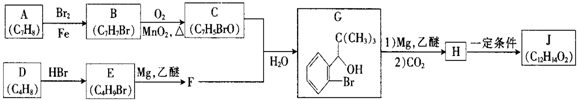
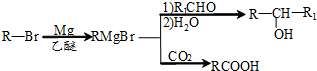
 (写明反应条件).
(写明反应条件).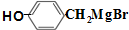 与CO2反应生成X,X的同分异构体中:
与CO2反应生成X,X的同分异构体中: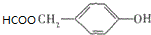 .
.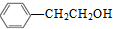 )的路线流程图(其它试剂任选).合成路线流程图表达方法例如下:
)的路线流程图(其它试剂任选).合成路线流程图表达方法例如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
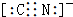 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
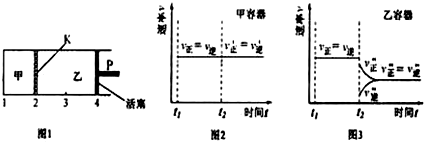
| A. | 保持温度和活塞位置不变,在甲中再加入1molA和2molB,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲中B的体积分数增大,乙中B的体积分数减小 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com