
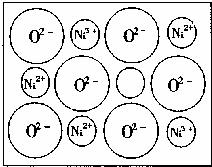
(2)天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如下图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为Ni0.97O,试计算该晶体中Ni3+与Ni2+的离子数之比。?

解析:(1)因为NiO的晶体结构与NaCl的晶体结构相同,均为正方体。从晶体结构模型中分割出一个小立方体,其中小立方体的边长为Ni2+与最邻近O2-的核间距离即a×10
Ni2+:![]() ,含O2-:
,含O2-: ![]() ,
,
所以( ![]() ×10-8)3×NA cm3是0.5 mol NiO具有的体积,则(
×10-8)3×NA cm3是0.5 mol NiO具有的体积,则(![]() ×10-8)-3NA cm3×ρ=0.5 mol×
×10-8)-3NA cm3×ρ=0.5 mol×![]() g·cm-3=
g·cm-3=![]() g·cm-3。解题的关键是确定晶胞的组成后,通过晶体组成计算出存在的微粒数。?
g·cm-3。解题的关键是确定晶胞的组成后,通过晶体组成计算出存在的微粒数。?
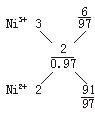
(2)设1 mol Ni0.97O中,含有Ni3+![]() mol,Ni2+为(0.97-
mol,Ni2+为(0.97-![]() )mol,根据晶体显电中性,即3
)mol,根据晶体显电中性,即3![]() mol+2(0.97-
mol+2(0.97-![]() )mol=2×1 mol,解得
)mol=2×1 mol,解得![]() =0.06,Ni2+为(0.97-
=0.06,Ni2+为(0.97-![]() )mol=0.91 mol,则离子数之比为Ni3+∶Ni2+=0.06∶0.91=6∶91。?
)mol=0.91 mol,则离子数之比为Ni3+∶Ni2+=0.06∶0.91=6∶91。?
答案:(1)![]() g·cm-3或
g·cm-3或![]() g·cm-3??
g·cm-3??
(2)6∶91


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
 (1)中学教材上图示了NaCl晶体结构,它向三维空间延伸得到完美晶体. NiO(氧化镍〕晶体的结构与NaQ相同,Ni2+与最邻近O2-的核间距离为a10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g.mol-1).
(1)中学教材上图示了NaCl晶体结构,它向三维空间延伸得到完美晶体. NiO(氧化镍〕晶体的结构与NaQ相同,Ni2+与最邻近O2-的核间距离为a10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g.mol-1).查看答案和解析>>
科目:高中化学 来源: 题型:
NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的核间距离为a×10-8 cm,计算NiO晶体的密度。(已知NiO的摩尔质量为74.7 g·mol-1)
(2)天然的和绝大部分人工制备的晶体都存在缺陷,例如在某种NiO晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果是晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为Ni0.97O,试计算该晶体中Ni3+与Ni2+的离子数之比。
查看答案和解析>>
科目:高中化学 来源: 题型:
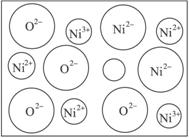
图3-40
(2)天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如图340所示的缺陷:一个Ni2+空缺,另两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物Ni和O的比值却发生了变化。某氧化镍样品组成为Ni0.97O,试计算晶体中Ni3+与Ni2+的离子数之比。
查看答案和解析>>
科目:高中化学 来源:2012年苏教版高中化学选修3 3.2离子键 离子晶体练习卷(解析版) 题型:计算题
(1)中学教材上所示的NaCl晶体结构,它向三维空间延伸,得到完美晶体。NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的核间距离为a×10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7 g·mol-1)。
(2)天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。其氧化镍样品组成为Ni0.97O,试计算该晶体中Ni2+与Ni3+的离子数之比。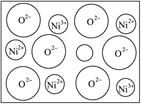
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com