
【题目】某化工厂排放的工业废水中主要含Na+、HSO3ˉ、SO42-,研究小组欲测定其中HSO3ˉ的浓度,设计如下三个方案。
量取20.00mL废水试样,用0.02moL·K-1MnO4标准溶液进行滴定。记录数据,计算。
回答下列问题
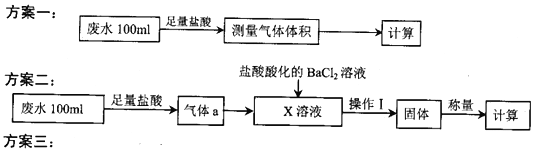
(1)利用右图所示的装置完成方案一
①仪器A的名称是______________。
②读数前,应进行的操作是____________________________。
③该方案存在较大的误差,可能的一种原因是____________________________。
(2)①方案二中吸收气体a的“X溶液”可能是______________ (填标号)。
a.Na2SO3溶液 b.双氧水 c.硝酸钠溶液 d.H2SO4酸化的KMnO4溶液
②若Ⅹ为次氯酸钠,写出气体a与X溶液反应的离子方程式____________________________。
③该方案中,操作I包含的操作名称依次为______________。
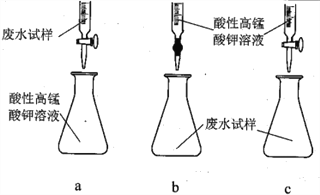
(3)①方案三设计的下列滴定方式中,最合理的是______________ (填标号)。该方案是否需要指示剂? ______________ (填“是”或“否”),原因是__________________________________________。
②滴定记录数据如下表:
滴定前读数/mL | 滴定后读数/mL | |
第一次 | 0.10 | 16.12 |
第二次 | 1.10 | 17.08 |
第三次 | 1.45 | 21.45 |
第四次 | 0.00 | 16.00 |
计算该废水试样中HSO3ˉ的浓度为______________ mol ·L-l。
【答案】 分液漏斗 调整BC装置液面相平 SO2可溶于水(合理即可) bc SO2+ClO-+H2O=SO42-+Cl-+2H+ 过滤、洗涤,干燥 c 否 高锰酸钾溶液本身有颜色,可指示终点(合理即可) 0.04
【解析】考查实验方案设计与评价,(1)①仪器A为分液漏斗;②读数前应使C中气体压强与外界压强相等,即读数前应进行的操作是调整BC装置液面相平;③SO2易溶于水,测量气体体积偏小;(2)①气体a为SO2,a、Na2SO3能与SO2反应生成NaHSO3,,但加入盐酸酸化的BaCl2溶液,不产生沉淀,故a错误;b、利用H2O2的强氧化性,把SO2氧化成SO42-,加入BaCl2溶液,产生BaSO4↓,测出沉淀的质量,根据元素守恒求出HSO3-的浓度,故b正确;c、NO3-在酸性条件下具有强氧化性,能把SO2氧化成SO42-,故c正确;d、H2SO4对HSO3-测定产生干扰,故d错误;②利用次氯酸钠的强氧化性,把SO2氧化成SO42-,本身被还原成Cl-,即ClO-+SO2→Cl-+SO42-,根据升降法以及原子守恒、电荷守恒配平,离子反应方程式为SO2+ClO-+H2O=SO42-+Cl-+2H+;③加入X溶液得到BaSO4沉淀,操作I是过滤、洗涤、干燥;(3)①盛放高锰酸钾溶液的滴定管是酸式滴定管,用废水滴定酸性高锰酸钾,颜色的变化不明显,应用酸性高锰酸钾溶液滴定废水,故c正确;高锰酸钾溶液本身有颜色,即为紫红色,可指示终点,因此不需要指示剂;②四次消耗标准液的体积分别是16.02、15.98、20.00、16.00,第三次与另外几次相差较大删去,因此三次平均消耗标准液的体积为(16.02+15.98+16.00)/3mL=16.00mL,根据得失电子数目守恒,16.00×10-3×0.02×5=n(HSO3-)×2,解得n(HSO3-)=8×10-4mol,浓度为8×10-4/20.00×10-3mol·L-1=0.04mol·L-1。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】波义耳在《怀疑的化学家》一书中说:“在火的单独作用下,玻璃容器中的水银会丧失其原有的银色,变成一种红色物质;而无须使用任何附加试剂,用这种红色物质也可以得到汞”。该过程可表示为:![]() 。下列说法错误的是
。下列说法错误的是
A. 波义耳所描述的变化属于氧化还原反应 B. 此反应可粗略测定空气中氧气的含量
C. 波义耳所描述的变化是一个可逆的化学反应 D. 用热分解法可由氧化汞制得单质汞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3![]() 2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
A. 5∶3 B. 5∶4 C. 1∶1 D. 3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2KMnO4+16HCl=2KCl+2MnCl2+5C12↑+8H2O
(1)用双线桥法标明电子转移的方向和数目。
(2)若有7.3g HCl被氧化,求体现酸性作用的HCl为多少摩?氧化产物与还原产物的质量比为多少(分子分母分别算出数值,不用约分)?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于非氧化还原反应的是
A. 2Na + Cl2 === 2NaCl B. MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O
C. 2KI+Cl2===2KCl+I2 D. MgO+2HCl===MgCl2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.化学反应中的能量变化都表现为热量变化
C.任何放热反应在常温下一定能发生反应
D.反应物和生成物所具有的总能量决定了反应是放热还是吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3溶液,再分别滴加下图所示的试剂:

对实验现象的“解释或结论”正确的是
选项 | 实验现象 | 解释或结论 |
A | a中溶液褪色 | 氧化性:SO32-<I- |
B | b中无现象,加硫酸后产生淡黄色沉淀 | 硫酸将S2-氧化为硫单质 |
C | c中滴入酚酞溶液变红,再加BaCl2溶液后产生白色沉淀且红色褪去 | 亚硫酸钠溶液中存在水解平衡 |
D | d中产生白色沉淀 | Na2SO3溶液已变质 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下①13.44 L CH4②6.02×1023个HCl分子③27.2 g H2S ④0.4 mol NH3,下列对这四种气体的关系从大到小表达错误的是
A. 体积②>③>①>④ B. 质量②>③>④>①
C. 密度②>③>④>① D. 氢原子个数①>③>④>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ka1(H2C2O4)=10-1.3, Ka2(H2C2O4)=10-4.2。用0.1000 mol·L-1 NaOH溶液滴定10.00 mL 0.1000 mol·L-1 H2C2O4溶液所得滴定曲线如右图。下列说法正确的是

A. 点①所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
B. 点②所示溶液中:c(HC2O4-)=c(C2O42-)
C. 点③所示溶液中:c(Na+)=c(HC2O4-) + c(C2O42-)
D. 点④所示溶液中:c(Na+) + 2c(H2C2O4) + 2c(H+)=2c(OH-) + 2c(C2O42-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com