
下列离子方程式正确的是
A.NH4HCO3溶液中加入少量稀NaOH溶液:NH4++ OH-=NH3·H2O
B.FeBr2溶液中通入足量的氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
C.硫酸亚铁溶液中加入用硫酸酸化的双氧水Fe2++2H++H2O2=Fe3++2H2O
D.在通入过量SO2后的NaOH溶液中加足量的溴水(不考虑SO2的溶解):HSO3-+Br2+H2O=3H++2Br-+SO42-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015广东省汕头市高一上学期10月月考化学试卷(解析版) 题型:填空题
(14分)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体(Cl2),而溶液的紫红色褪去。现有一个氧化还原反应的体系中,共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是__________,化合价没有发生变化的反应物是_____________。
(2)该反应中,发生还原反应的过程是(填化学式)___________→____________。
(3)上述反应中,1 mol氧化剂在反应中______(填“得到”或“失去”)______mol电子。
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色,说出NaBiO3的一个化学性质: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高三上学期期末考试化学试卷(解析版) 题型:选择题
下列物质露置在空气中,因发生氧化还原反应而变质的是
A.氢氧化钠 B.氯化亚铁 C.食盐 D.碳酸氢钠
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高三上学期期末考试化学试卷(解析版) 题型:选择题
下列互为同位素的是
A.613C和C60 B.白磷和红磷 C.乙醇和甲醚 D.11H和12H
查看答案和解析>>
科目:高中化学 来源:2015年湖北省荆门市高三元月调考理综化学试卷(解析版) 题型:填空题
(15分)甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ/mol,甲醚可作燃料电池的燃料。
(1)写出甲醚燃烧的热化学方程式 ;已知H2(g)和C(s)的燃烧热分别是285.8 kJ·mol-1、393.5 kJ·mol-1;计算反应4C(s)+6H2(g)+O2(g)==2CH3OCH3 (g)的反应热为 ;
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g) CH3OCH3(g)+3H2O(g) △H<0
CH3OCH3(g)+3H2O(g) △H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是
______(选填编号,注意大小写)
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产率将
________(填“变大”、“变小”或“不变”,下同),混合气体的平均式量将__________;
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式为____________________;
(4)用(3)中的燃料电池为电源,以石墨为电极电解500 mL滴有酚酞的NaCl溶液,装置如图所示:

请写出电解过程中Y电极附近观察到的现象 ;当燃料电池消耗2.8 LO2(标准状况下)时,计算此时:NaCl溶液的pH= (假设溶液的体积不变,气体全部从溶液中逸出)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市七校高三上学期期末联考理综化学试卷 (解析版) 题型:填空题
(共16分)
Ⅰ.(10分)已知2A(g)+B(g)  2C(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ。
2C(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ。
(1)比较a b( 填 > 、 = 、 < )
(2)若在原来的容器中,只加入2mol C,500℃时充分反应达平衡后,吸收热量ckJ,C物质的浓度 (填>、=、<)w mol/L,a、b、c之间满足的关系式为 (用含a、b、c的代数式表示)。
(3)能说明该反应已经达到平衡状态的是 。
a、V(C)=2V(B); b、容器内压强保持不变
c、V逆(A)=2V正(B) d、容器内的密度保持不变
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA和lmolB,500℃时充分反应达平衡后,放出热量d kJ,则d b ( 填 > 、 = 、 < ),
Ⅱ.(6分)用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),
NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH)+MH Ni(OH)2+M
Ni(OH)2+M
(1)电池放电时,负极的电极反应式为_______
(2)充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市七校高三上学期期末联考理综化学试卷 (解析版) 题型:选择题
已知:HCN(aq)与NaOH(aq)反应的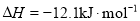 ;HCl(aq)与NaOH(aq) 反 应的
;HCl(aq)与NaOH(aq) 反 应的 ,则HCN在水溶液中电离的
,则HCN在水溶液中电离的 等于
等于
A.
 B.-43.5
B.-43.5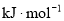
C.+43.5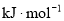 D.+67.7
D.+67.7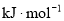
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省宁波市高三一月化学试卷(解析版) 题型:填空题
(12分)
(1)20℃时0.1 mol·L-1NaOH分别滴定0.1 mol·L-1HCl、0.1 mol·L-1CH3COOH的pH变化曲线如下。

根据上述曲线回答下列问题:
①测得醋酸起点pH为3,则20℃时该浓度醋酸的电离度为 ;
②滴定开始后醋酸曲线变化比盐酸快的原因是 ;
(2)25 ℃时0.1 mol·L-1的H2R水溶液中,用氢氧化钠来调节溶液pH,得到含有H2R、HR-、R2-三种微粒的溶液。当c(Na+)=c(R2-)+c(HR-)+c(H2R)时溶液的溶质为 (填化学式)。
(3)下图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。

①下列叙述正确的是 。
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵。已知弱电解质在水中的电离平衡常数(25℃)如下表:
弱电解质 | H2CO3 | NH3·H2O |
电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①你认为该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②就该溶液中粒子之间有下列关系式,你认为其中正确的是 。
A.c (NH4+)>c (CO32-)>c (HCO3-)>c (NH3·H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c (CO32-) + c (HCO3-) +c (H2CO3)=0.1 mol·L-1
D.c (NH4+)+ c (NH3·H2O)=2 c (CO32-) + 2c (HCO3-) +2 c (H2CO3)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州地区7校高三上学期期末模拟联考化学试卷(解析版) 题型:选择题
樱桃是一种抗氧化的水果,对人体有很大的益处,樱桃中含有一种羟基酸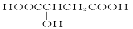 具有健脾作用。下列有关说法正确的是
具有健脾作用。下列有关说法正确的是
A.该羟基酸含有3种官能团
B.通常条件下,该羟基酸可以发生取代、氧化和加成反应
C.该羟基酸可以在Cu的催化下被O2氧化成醛
D.含1mol该羟基酸的溶液可与含2mol氢氧化钠的溶液恰好完全反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com