
【题目】根据右表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各离子浓度的关系正确的是:
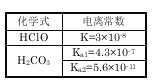
A.c(HCO3-)>c(ClO-)>c(OH-)
B.c(ClO-)>c(HCO3-)>c(H+)
C.c(ClO-)+c(HClO)=c(HCO3-)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)
【答案】A
【解析】
试题分析:A、由表中信息可知,电离常数:H2CO3>HClO>HCO3->H2O,由酸越弱其对应盐的水解程度越大可知,水解程度(或转化率):HCO3-<ClO-(一般都在10%以下),则达到水解平衡时盐溶液中:c(HCO3-)>c(ClO-)>c(OH-),A正确;B、由表中数据可知,H2CO3的酸性大于HClO,则ClO-的水解程度大于HCO3-,则c(HCO3- )>c(ClO-),B错误;C、物质的量浓度相等NaClO、NaHCO3混合溶液中,根据物料守恒得c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-),C错误;D.由电荷守恒可知,溶液中存在c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)+2c(CO32-),D错误,答案选A。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中将2molNaHCO3(s)和一定量Na2O2混合,在加热条件下让其充分反应,150℃下所得气体仅含2种组分,反应后固体的物质的量(n)的取值范围是( )
A. n≥1 B. 1<n<2 C. 2≤n<4 D. n≥4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示装置中进行氨的催化氧化实验:往三颈瓶内的浓氨水中不断通入空气,将红热的铂丝插入瓶中并接近液面。反应过程中,可观察到瓶中有红棕色气体产生,铂丝始终保持红热。下列有关说法错误的是( )

A. 反应后溶液中含有NO3-
B. 反应后溶液中c(H+)增大
C. 实验过程中有化合反应发生
D. 实验过程中NH3H2O的电离常数不可能发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016江苏卷】下列图示与对应的叙述不相符合的是( )
A.图甲表示燃料燃烧反应的能量变化
B.图乙表示酶催化反应的反应速率随反应温度的变化
C.图丙表示弱电解质在水中建立电离平衡的过程
D.图丁表示强碱滴定强酸的滴定曲线

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,下列说法正确的是

A. 0-t1时,原电池的负极是铜片
B. 0-t1时,正极的电极反应式是2H++2e-=H2↑
C. t1时刻,电流方向发生变化的原因是Al 在浓硝酸中发生钝化,氧化膜阻止了Al进一步反应
D. tl时刻后,电子从铝经过导线流向铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素是______。(用元素符号表示)
(2)②③④三种元素的原子半径从大到小的顺序是______(用元素符号表示)
(3)用电子式表示③与⑦形成化合物的过程_______________________。
(4)在①~⑧元素中,元素的最高价氧化物对应的水化物中碱性最强的___。(填化学式)
(5)在⑦与⑩的单质中,化学性质较活泼的是_____。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 2.0gH218O与D2O的混合物中所含中子数为NA
B. 50mL18mol·L-1浓硫酸与足量铜供热,转移电子数为0.9NA
C. 0.1molCl2通入含0.1molFeBr2溶液中,被氧化的溴离子数为0.2NA
D. 标准状况下,2.24LNO和足量O2反应生成物中含有NO2分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ·mol-1,甲醚可作燃料电池的燃料。
(1) 写出甲醚燃烧的热化学方程式___________________ ;已知H2(g)和C(s)的燃烧热分别是285.8 kJ·mol-1、393.5 kJ·mol-1;计算反应:4C(s)+ 6H2(g)+ O2(g) = 2CH3OCH3(g)的反应热为___________
(2) 工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)![]() CH3OCH3(g)+3H2O(g)△H<0
CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应。下列能判断反应达到化学平衡状态的是___________(选填编号,注意大小写)
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时,有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后,达到新的平衡,CH3OCH3的产率将________(填“变大”、“变小”或“不变”)
(3) 以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式的其中一个产物是CO32-,请写出该反应的负极反应式___ _ ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com