
【题目】在100 mL某一元弱酸的溶液中,以0.50 mol/L氢氧化钠溶液滴定后得滴定曲线如图所示。

下列叙述正确的是( )
A.该弱酸在滴定前的浓度是0.15 mol/L
B.该弱酸稀释10倍后pH为4
C.滴定过程为求滴定终点,最合适的指示剂是酚酞
D.滴定过程为求滴定终点,最合适的指示剂是甲基橙
【答案】C
【解析】
由图可知,用NaOH滴定弱酸溶液达到终点pH范围是在7~11,该变色范围最合适的指示剂是酚酞,用去NaOH的体积是20 mL,该弱酸滴定前的浓度是20×0.50/100=0.10(mol·L-1),因为滴定前该弱酸的pH=3,溶液在稀释过程中会继续电离,所以pH小于4。
A、由图开始时,弱酸的PH=3,用NaOH滴定该弱酸溶液达到终点pH范围是在7~11,变色范围最合适的指示剂是酚酞,用去NaOH的体积是20 mL,该弱酸滴定前的浓度是20×0.5/100=0.10mol·L-1,故A错误;
B、滴定前该弱酸的pH=3,溶液在稀释过程中会继续电离,该弱酸稀释10倍后,pH小于4,故B错误;
C、用NaOH滴定该弱酸溶液达到终点pH范围是在7~11,变色范围最合适的指示剂是酚酞,故C正确;
D、NaOH滴定该弱酸溶液达到终点pH范围是在7~11,变色范围最合适的指示剂是酚酞,故D错误;
故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氯化铁和高铁酸钾都是常见的水处理剂。某兴趣小组以铁屑为原料模拟工业上制备氯化铁及进一步氧化制备高铁酸钾的流程如下:

请回答下列问题:
(1)“氧化”阶段通入过量空气比用氯气作氧化剂具有的优点是__________________________________。
(2)“合成”阶段生成Na2FeO4的离子方程式为__________________________________。
(3)为了检验“氧化”过程中所得FeCl3溶液中是否含有Fe2+,某同学取少量溶液于试管中,选用下列试剂可以达到目的的是_______(填字母)。
a.KSCN溶液 b.NaOH溶液 c.K3[Fe(CN)6]溶液 d.苯酚溶液
若选用酸性K MnO4溶液进行检验,请分析方案是否合理,并说明理由:_____________________________。
(4)过程①制取FeCl3固体的具体操作步骤是_____________________________________________________。若使6.4mol/LFeCl3饱和溶液不析出Fe(OH)3,需控制溶液的pH小于_______{已知该实验条件下,Ksp[(Fe(OH)3]=8.5×10-36,Kw=1.1×10-13,1.13≈1.33}
(5)在不同温度和不同pH下,FeO42-的稳定性如下图所示:

从上图分析,为了提高“合成”阶段Na2FeO4的产率,可采取的实验条件范围为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示![]() 部分产物略去
部分产物略去![]() ,则下列有关物质的推断不正确的是
,则下列有关物质的推断不正确的是
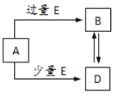
A.若A是铁,则E可能为稀硝酸
B.若A是![]() ,E是
,E是![]() ,则B为
,则B为![]()
C.若A是NaOH溶液,E是![]() ,则B为
,则B为![]()
D.若A是![]() 溶液,E可能是氨水
溶液,E可能是氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A.此酸的电离平衡常数约为1×10-7
B.升高温度,溶液的pH增大
C.该溶液的pH=4
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐是优良的多功能水处理剂。某实验小组釆用如图装置制备高铁酸钾(K2FeO4)并探究其性质用途。

Ⅰ.制备K2FeO4(夹持、加热等装置略)

(1)B中所用试剂为______________________。
(2)C中反应为放热反应,而反应温度须控制在0~8℃,可使用的控温方法为___________,充分反应后得到紫色固体,反应方程式为___________。反应中KOH必须过量的原因是___________。
(3)C中混合物经过滤、洗涤、干燥,得纯浄髙铁酸钾晶体,洗涤时洗涤剂可选用___________。
a.冰水 b.KOH溶液 c.异丙醇
Ⅱ.探究K2FeO4的性质
(4)K2FeO4可以将废水中的CN-氧化为CNO-,实验表明,pH=9时CN-去除效果最佳。配平反应离子方程式:____FeO42-+____CN-+____H2O→____Fe(OH)3↓+____CNO-+___OH-。
现处理含CN-离子浓度为13mg/L的废水1m3,至少需要K2FeO4___________g。
(5)资料表明,酸性溶液中氧化性FeO42->MnO4-。验证实验:将少K2FeO4溶解在过量KOH溶液中,溶液呈浅紫色,取该溶液滴入MnSO4和H2SO4的混合溶液中,振荡,溶液颜色仍然呈浅紫色。请设计实验证明最后所得浅紫色溶液中含有MnO4-___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图,若烧瓶是干燥的。当烧瓶口向上时,由A口导入气体,可收集下列中的____________(填序号,下同)气体。若烧瓶充满水,可收集下列中的________气体。
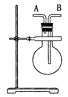
① NO ②NH3 ③SO2 ④ NO2
(2)若烧瓶中事先已集满一瓶氨气,并将烧瓶口向下放置,由______口导入气体可收集NO气体,其原因是 ____________________________________________。
(3)实验室通常制备氨气的化学方程式 ______________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁中发生的反应为:FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H>0。已知t℃时,平衡常数K=0.25。
Fe(s)+CO2(g) △H>0。已知t℃时,平衡常数K=0.25。
(1)温度升高,化学平衡移动后达到新的平衡,平衡常数K_____(填“增大”、“减小”或“不变”,下同),高炉内CO2和CO的体积比____
(2)t℃时测得高炉中c(CO2)=0.020 mol·Lˉ1,c(CO)=0.1 mol·Lˉ1,在这种情况下,该反应是否处于化学平衡状态_______(填“是”或“否”),此时,化学反应速率是υ(正)_____υ(逆)(填“大于”、“小于”或“等于”),其原因是________________
(3)若在1L密闭容器中加入0.02mol FeO(s),并通入x mol CO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=_______________。
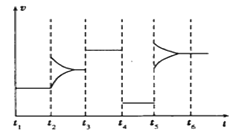
(4)如图为t2时刻后改变条件平衡体系中化学反应速率随时间变化的情况,且四个阶段各改变一种条件并且改变的条件均不同。已知,t3~t4阶段为使用催化剂,则t4时刻改变的条件为_____________,t5时刻改变的条件为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别向100mL浓度均为2mol/L的硫酸和NaOH溶液中加入4.5g金属铝,充分反应产生的气体在同温同压下体积比为
A.1:1B.2:3C.4:5D.5:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com