
【题目】氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.根据要求回答有关问题: 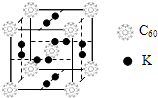
①已知金刚石中的C﹣C的键长为154.45pm,C60中C﹣C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确:(填“正确”或“错误”)并阐述理由 .
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体.该物质的K原子和C60分子的个数比为 .
③继C60后,科学家又合成了Si60、N60 , Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则28g Si60分子中π键的数目为 .
【答案】错误;金刚石属于原子晶体,熔化时需要破坏化学键,C60为分子晶体,熔化时破坏的是分子间作用力,无需破坏共价键,而分子间作用力较弱,所需能量较低,故C60熔点低于金刚石;3:1;0.5 NA
【解析】解:①金刚石属于原子晶体,熔化时需要破坏化学键,C60为分子晶体,熔化时破坏的是分子间作用力,无需破坏共价键,而分子间作用力较弱,所需能量较低,故C60熔点低于金刚石,所以答案是:错误;金刚石属于原子晶体,熔化时需要破坏化学键,C60为分子晶体,熔化时破坏的是分子间作用力,无需破坏共价键,而分子间作用力较弱,所需能量较低,故C60熔点低于金刚石;②根据均摊法,可知晶胞中C60分子数目为1+8× ![]() =2、K原子数目=12×
=2、K原子数目=12× ![]() =6,则K原子和C60分子的个数比为6:2=3:1,所以答案是:3:1;③Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,所以每个硅原子和其中两个硅原子形成共价单键,和另外的一个硅原子形成共价双键,平均每个Si原子含有0.5个π键,28g Si60分子中Si原子物质的量为
=6,则K原子和C60分子的个数比为6:2=3:1,所以答案是:3:1;③Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,所以每个硅原子和其中两个硅原子形成共价单键,和另外的一个硅原子形成共价双键,平均每个Si原子含有0.5个π键,28g Si60分子中Si原子物质的量为 ![]() =1mol,分子中含有0.5molπ键,则含有π键数目为0.5 NA , 所以答案是:0.5 NA .
=1mol,分子中含有0.5molπ键,则含有π键数目为0.5 NA , 所以答案是:0.5 NA .
【考点精析】解答此题的关键在于理解原子晶体的相关知识,掌握相邻原子间以共价键相结合而形成空间网状结构的晶体叫原子晶体.


科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL 0.10molL﹣1氨水中滴入0.10molL﹣1的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10molL﹣1氨水的电离度为1.32%,下列有关叙述正确的是( ) 
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0mL
C.M点处的溶液中c(NH4+)=c(Cl﹣)=c(H+)=c(OH﹣)
D.N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学反应,下列叙述中不正确的是( ) ①放热的反应发生时不必加热
②化学反应一定有能量变化
③吸热反应需要加热后才能发生
④化学反应热效应数值(放出或吸收的热量)与参加反应的物质的多少有关.
A.①②
B.②③
C.①③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y,Z,W,Q,R均为前四周期元素,且原子序数依次增大,其相关信息如表所示:
X的基态原子中电子分布在三个不同的能级中且每个能级中电子总数相同 |
Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
Z元素的族序数是周期数的三倍 |
W原子的第一至第六电离能分别为: |
Q为前四周期中电负性最小的元素 |
R位于周期表中的第11列 |
(1)R基态原子的价电子排布图为 , R在周期表中位于区.
(2)X,Y,Z的第一电离能由大到小的顺序为(用元素符号表示).
(3)含有元素Q的盐的焰色反应为色,许多金属盐都可以发生焰色反应,其原因是 .
(4)Q单质形成的晶体的堆积模型为 , 配位数是 .
(5)光谱证实单质W与强碱溶液反应有[W(OH)4]﹣生成,则[W(OH)4]﹣中存在(填字母).
a.极性共价键 b.非极性共价键 c.配位键 d.σ键 e.π键.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据科学家预测,月球的土壤中吸附着数百万吨的 ![]() He,每百吨
He,每百吨 ![]() He核聚变所释放的能量相当于目前人类一年消耗的能量.在地球上,氦元素主要以
He核聚变所释放的能量相当于目前人类一年消耗的能量.在地球上,氦元素主要以 ![]() He的形式存在.下列说法正确的是( )
He的形式存在.下列说法正确的是( )
A.![]() He原子核内含有4个质子
He原子核内含有4个质子
B.![]() He和
He和 ![]() He互为同位素
He互为同位素
C.![]() He原子核内含有3个中子
He原子核内含有3个中子
D.![]() He最外层电子数为2,具有较强金属性
He最外层电子数为2,具有较强金属性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图中包含的信息分析,下列叙述正确的是( ) 
A.氢气与氯气反应生成1 mol氯化氢气体,反应吸收248 kJ的能量
B.436 kJ/mol是指断开1 mol H2中的H﹣H键需要放出436 kJ的能量
C.氢气与氯气反应生成2 mol氯化氢气体,反应放出183 kJ的能量
D.431kJ/mol是指生成2 mol HCl中的H﹣Cl键需要放出431 kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是元素周期表的一部分.
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
根据①~元素在周期表中的位置,回答下列有关问题:(请用化学符号填写)
(1)写出下列元素符号:① , ⑥ .
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是 , 碱性最强的是 , 呈两性的氢氧化物是 . (用化学式填写)
(3)在这些元素中单质的氧化性最强的是 , 还原性最强的是 . 化学性质最不活泼的元素是 . (用化学式填写)
(4)画出原子结构示意图: .
(5)用电子式表示⑦和⑩形成化合物的过程: .
(6)⑦和⑧分别形成的气态氢化物的化学式是、 . 其中相对不稳定的是 .
(7)在③与④中,化学性质较活泼的是(填元素符号),在⑧与中,化学性质较活泼的是 , (填元素符号)如何证明(用离子方程式表示): .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42﹣)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为( )
A.13.5L
B.9.0L
C.16.8L
D.15.7L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com