
| A | 实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 | |
| B | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 | |
| C | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,平衡时氢气转化率增大 | |
| D | 吸热反应“TiO2(s)+2Cl 2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行, 则该反应的△S<0 |
| A. | A | B. | B | C. | C | D. | D |
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为18的氯原子:${\;}_{17}^{35}$Cl | B. | 二氧化碳分子的比例模型: | ||
| C. | HClO的电子式: | D. | 对羟基苯甲醛的结构简式:OH- -CHO -CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子总数相同 | B. | 物质的量相同 | C. | 分子总数相同 | D. | 质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将40g NaOH溶解在1L水中 | |
| B. | 将22.4L HCl气体溶于水配成1L溶液 | |
| C. | 将0.1L 10 mol•L-1浓硫酸加入0.9L水中 | |
| D. | 将25g 胆矾溶于水配成100mLCuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
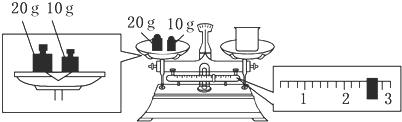
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氢化钙(CaH2)是二种常用的储氢材料,也是登山运动员常用的能源提供剂,需要密封保存,遇水反应生成氢氧化钙和氢气.•某研究性学习小组模拟生产企业制取氢化钙
氢化钙(CaH2)是二种常用的储氢材料,也是登山运动员常用的能源提供剂,需要密封保存,遇水反应生成氢氧化钙和氢气.•某研究性学习小组模拟生产企业制取氢化钙| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| 取少量固体样品,•… |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com