
【题目】现用18.4 mol/L的浓H2SO4来配制500mL0.2 mol/L的稀H2SO4。可供选择的仪器有:①玻璃棒②烧瓶③烧杯④胶头滴管⑤量筒⑥托盘天平⑦药匙。
请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时不需要使用的有_____________(填代号),还缺少的仪器是______________________。
(2)经计算,需浓H2SO4的体积为___________,量取浓硫酸时应选用___________(填序号)(选填①10mL、②50mL、③100mL三种规格)的量筒。
(3)将所配制的稀H2SO4进行测定,发现浓度小于0.2 mol/L。请你分析配制过程中可能引起浓度偏低的原因是___________(填字母)。
a.定容时俯视标线 b.烧杯和玻璃棒没有洗涤
c.加蒸馏水不慎超过刻度线 d.容量瓶使用前内壁沾有水珠
e.定容时仰视标线
【答案】②⑥⑦ 500mL容量瓶 5.4mL ① bce
【解析】
(1)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
(2)根据稀释前后硫酸的物质的量不变求出浓H2SO4的体积;根据溶液的体积选取稍大的量筒;
(3)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=![]() 分析判断。
分析判断。
(1)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)量取浓硫酸,在烧杯中稀释,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:玻璃棒、烧杯、胶头滴管、量筒、500mL容量瓶,不需要的仪器有②⑥⑦;还缺少的仪器是500mL容量瓶;
(2)稀释前后硫酸的物质的量不变,设浓H2SO4的体积为VmL,则18.4mol/L×VmL=500mL×0.2mol/L,解得V=5.4mL,选用量筒的规格为10mL,故选①;
(3)a、定容时俯视刻度线,使溶液的体积偏小,所以溶液浓度偏高,故不选a;
b、烧杯和玻璃棒没有洗涤,硫酸的物质的量偏小,所以溶液浓度偏低,故选b;
c、加蒸馏水不慎超过刻度线,使溶液的体积偏大,所以溶液浓度偏低,故选c;
d.定容时需要加水,所以容量瓶使用前内壁沾有水珠,对溶液浓度无影响,故不选d;
e、定容时仰视刻度线,使溶液的体积偏大,所以溶液浓度偏低,故选e。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】氯化铁和摩尔盐是铁的两种重要盐类,在净水和定量分析等方面具有重要作用。
(1) 用FeCl3溶液腐蚀印刷电路板上的铜,向所得溶液中加入铁粉,对加入铁粉充分反应后的溶液分析合理的是____________。
a. 若无固体剩余,则溶液中一定有Fe3+ b. 若有固体存在,则溶液中一定有Fe2+
c. 若溶液中有Cu2+,则一定没有固体析出 d. 若溶液中有Fe2+,则一定有Cu析出
(2)工业上通过氧化酸性FeCl2废液得到含FeCl3的溶液。若酸性FeCl2废液中 ![]() ,
,![]() ,
,![]() ,则该溶液的
,则该溶液的![]() 约为______(不考虑水的电离和离子的水解)。
约为______(不考虑水的电离和离子的水解)。
(3)摩尔盐 [(NH4)2Fe(SO4)26H2O]在定量分析中常作为基准物质,用来标定重铬酸钾、高锰酸钾等溶液的浓度,在![]() 的该盐的溶液中,离子浓度由大到小的顺序是____________。
的该盐的溶液中,离子浓度由大到小的顺序是____________。
(4)摩尔盐与酸性高锰酸钾发生反应:![]()
a.配平上述离子方程式:(___________)Fe2++(____________)MnO4-+(___________)H+→(_________)Mn2++(__________)Fe3++(___________)H2O
b.已知摩尔盐相对分子质量为![]() ,取摩尔盐产品
,取摩尔盐产品![]() (杂质不与高锰酸钾反应),配成
(杂质不与高锰酸钾反应),配成![]() 溶液,取出
溶液,取出![]() 用
用![]() 溶液滴定,消耗
溶液滴定,消耗![]() 溶液
溶液![]() ,则产品中摩尔盐的质量分数为____________(用小数表示,保留四位小数)。
,则产品中摩尔盐的质量分数为____________(用小数表示,保留四位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有物质的量浓度均为0.1mo/L的下列溶液:
(1)①NH3·H2O ②FeCl2 ③NaHSO4 ④KOH ⑤Ba(OH)2 ⑥H2SO4,其pH由大到小的顺序排列的是(填序号)___。
(2)写出氯化亚铁溶液中,亚铁离子水解的离子方程式___。
(3)写出硫酸氢钠与氢氧化钡2:1反应的离子方程式___。
(4)将氢氧化钾与氯化亚铁溶液混合,现象___。依次发生的化学方程式____、___。
(5)氯化亚铁保存时为何加少量铁粉___,若保存硫酸铁溶液时应向溶液中加入____。
(6)如何利用氯水和硫氰化钾检验氯化亚铁溶液中的Fe2+,写出加入试剂的先后顺序和对应现象__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前铬被广泛应用于冶金、化工、铸铁及高精端科技等领域。回答下列问题:
(1)基态Cr原子价层电子的轨道表达式为_______,其核外有_______种不同能量的电子。
(2)Cr的第二电能离(ICr)和Mn的第二电离能(IMn)分别为1590.6 kJ·mol-1、1509.0 kJ·mol-1,ICr > IMn的原因是____________。
(3)过氧化铬CrO5中Cr的化合价为+6,则该分子中![]() 键、
键、![]() 键的数目之比为______。
键的数目之比为______。
(4)CrCl3的熔点(83℃)比CrF3的熔点(1100℃)低得多,这是因为___________。
(5)Cr的一种配合物结构如图所示,该配合物中碳原子的杂化方式是_______,阳离子中Cr原子的配位数为_________,ClO![]() 的立体构型为________。
的立体构型为________。

(6)氮化铬晶体的晶胞结构如图所示,Cr处在N所围成的________空隙中,如果N与Cr核间距离为apm,则氮化铬的密度计算式为__________g·cm-3(NA表示阿伏加德罗常数的值)。
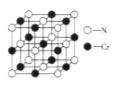
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 KI可催化H2O2分解,机理为:①H2O2+I-→H2O+IO-;②H2O2+IO-→H2O+O2↑+I-。反应过程中能量变化如图所示,下列判断错误的是( )
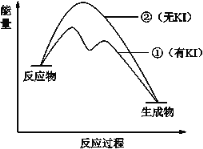
A.KI改变了反应的途径B.KI不能改变总反应的能量变化
C.H2O2+Iˉ→H2O+IOˉ是放热反应D.反应物总能量高于生成物总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(![]() )俗称草酸,在实验研究和化学工业中应用广泛。完成下列填空:
)俗称草酸,在实验研究和化学工业中应用广泛。完成下列填空:
(1)室温下,测得![]() 溶液的
溶液的![]() ,写出草酸的电离方程式______。
,写出草酸的电离方程式______。
(2)草酸溶液中微粒的物质的量分数随溶液![]() 变化如图所示:
变化如图所示:
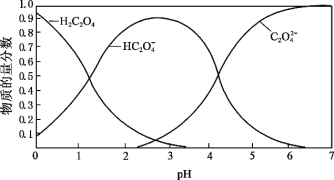
i.向草酸溶液中滴加![]() 溶液至
溶液至![]() 时发生的主要反应的离子方程式是:_______。
时发生的主要反应的离子方程式是:_______。
ii.继续加入![]() ,调节
,调节![]() 由2.5直至大于6.5,调节过程中
由2.5直至大于6.5,调节过程中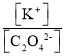 比值将________(选填“增大”、“减小”或“不变”)。
比值将________(选填“增大”、“减小”或“不变”)。
(3)工业上制取草酸的原理为:![]()
该反应的平衡常数表达式![]() _______,下列能说明反应已经达到平衡的是______。
_______,下列能说明反应已经达到平衡的是______。
a 平衡常数K保持不变 b 反应液的pH保持不变
c 丁醇的浓度保持不变 d 反应液的总质量保持不变
(4)草酸可用于测定高锰酸钾的质量分数,原理如下:![]()
i.一定条件下,测得上述反应中溶液中![]() 的浓度随反应时间的变化如图,以
的浓度随反应时间的变化如图,以![]() 浓度的变化表示此反应
浓度的变化表示此反应![]() 内的平均反应速率为____________
内的平均反应速率为____________![]()
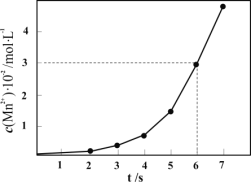
ii.分析![]() 的浓度随反应时间的变化的可能原因(反应过程中温度没有明显变化)_____。
的浓度随反应时间的变化的可能原因(反应过程中温度没有明显变化)_____。
(5)取![]() 的高锰酸钾产品,配成
的高锰酸钾产品,配成![]() 溶液,取出
溶液,取出![]() ,消耗
,消耗![]() 草酸标准溶液
草酸标准溶液![]() ,则样品中高锰酸钾的质量分数为______。
,则样品中高锰酸钾的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。
请回答下列问题。
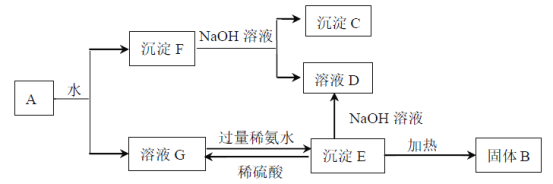
(1)图中涉及分离溶液与沉淀的方法是______________________________。
(2)B、C、D、E4种物质的化学式为:B___________、C___________、D___________、E___________。
(3)沉淀F与NaOH溶液反应的离子方程式为_________________________________。溶液G与过量稀氨水反应的化学方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
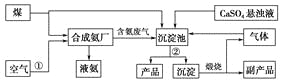
【题目】“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:
请回答下列问题:
(1)工艺操作①、②分别为____________、____________。
(2)工业合成氨的化学方程式为:__________。
(3)写出生成“产品”的离子方程式:________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________。
(5)副产品的化学式为________________。该联合生产工艺中可以循环使用的物质是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯),下列说法正确的是( )
Si(纯),下列说法正确的是( )
A.步骤①的化学方程式为SiO2+C![]() Si+CO2↑
Si+CO2↑
B.步骤①、②、③中每生成或反应1 mol Si,转移4 mol电子
C.二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D.SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com