
| A. | c(CO32-)+c(HCO3-)=0.3mol•L-1 | B. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H-) | ||
| C. | c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | D. | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
分析 将0.1mol天然碱(2Na2CO3•NaHCO3•2H2O)溶于水配成1L溶液,所得溶液中c(Na2CO3)=0.2mol/L、c(NaHCO3)=0.1mol/L,
A.根据混合液中的物料守恒判断;
B.碳酸根离子、碳酸氢根离子的水解,溶液呈碱性,则c(OH-)>c(H+),由于水解程度较小,则c(CO32-)>c(HCO3-);
C.碳酸根离子带有两个单位负电荷,根据电荷守恒判断;
D.根据碳酸钠、碳酸氢钠的浓度及物料守恒分析.
解答 解:将0.1mol天然碱(2Na2CO3•NaHCO3•2H2O)溶于水配成1L溶液,所得溶液中c(Na2CO3)=0.2mol/L、c(NaHCO3)=0.1mol/L,
A.溶液中还存在碳酸,根据物料守恒可得:c(H2CO3)+c(CO32-)+c(HCO3-)=0.3mol•L-1,故A错误;
B.溶液中c(Na2CO3)=0.2mol/L、c(NaHCO3)=0.1mol/L,则钠离子浓度最大,碳酸根离子、碳酸氢根离子的水解,溶液呈碱性,则c(OH-)>c(H+),由于水解程度较小,则c(CO32-)>c(HCO3-),溶液中离子浓度大小为:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+),故B正确;
C.根据混合液中的电荷守恒可知:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故C错误;
D.根据混合液中的物料守恒可得:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3),故D错误;
故选B.
点评 本题考查离子浓度大小比较,题目难度中等,明确溶液中溶质组成为解答关键,注意掌握盐的水解原理、电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 煤经过气化、液化等物理变化可转变为清洁燃料 | |
| B. | 在食品包装时放入盛有铁粉的透气小袋可防止食品氧化变质 | |
| C. | 为补充土壤中的钾元素,可在田间焚烧桔秆 | |
| D. | 聚乙烯、聚氯乙烯均可作包装材料,且不会造成环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z 三种短周期元素,原子半径的大小关系为:r(Y)>r(X)>r(Z),原子序 数之和为 16.X、Y、Z 三种元素的常见单质在适当条件下可发生如图所示变化,其中 B 和 C 均为 10 电子分子.下列说法不正确的是( )
X、Y、Z 三种短周期元素,原子半径的大小关系为:r(Y)>r(X)>r(Z),原子序 数之和为 16.X、Y、Z 三种元素的常见单质在适当条件下可发生如图所示变化,其中 B 和 C 均为 10 电子分子.下列说法不正确的是( )| A. | X 元素位于ⅥA | B. | A 不能溶解于 B 中 | ||
| C. | B 的沸点高于 C 的沸点 | D. | A 和 C 不可能发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 相关实验 | 试剂 | 现象和结论 |
| ① | 鉴别K2CO3和Na2SO4 | 盐酸、澄清的石灰水 | 产生无色无味气体,能使澄清的石灰水变浑浊的是K2CO3 |
| ② | 鉴别NO2和Br2蒸气 | 湿润的淀粉KI试纸 | 试纸变蓝色的是Br2蒸气 |
| ③ | 鉴别葡萄糖和蔗糖 | 银氨溶液 | 有银镜产生的葡萄糖 |
| ④ | 将装满氯水的圆底烧瓶倒置在有氯水的水槽中,日光照射 | -- | 烧瓶内有气泡产生,说明日光照射导致溶解的Cl2逸出 |
| A. | ①③ | B. | ①② | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C |
| D |
| A. | 原子半径由大到小的顺序为E>B>D>C>A | |
| B. | 元素D可形成多种酸,它们的酸根均能促进水的电离 | |
| C. | EB2中存在离子键与非极性共价键 | |
| D. | C位于周期表中第二周期第ⅦA族,其最高正价为+7 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高二上第一次月考化学试卷(解析版) 题型:填空题
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
(1)Y、Z、W元素的第一电离能由大到小的顺序是 。
(2)K的电子排布式是 。
(3)Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ;Y、Z的这些氢化物的沸点相差较大的主要原因是 。
(4)若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ;1 mol该分子中含有σ键的数目是 。
(5)Z、K两元素形成的某化合物的晶胞结构如右图所示,则该化合物的化学式是 ,Z原子的配位数是 。

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子的半径:Z>R>W>Y | |
| B. | Y、Z、W 三种元素组成的化合物的水溶液可能显碱性 | |
| C. | Z 与 Y、Z 与 W 形成的化合物的化学键完全相同 | |
| D. | WY2、Y3 等可作为新的自来水消毒剂替代 W2,主要原因是 WY2、Y3 的氧化性比 W2 更强 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高二上第一次月考化学试卷(解析版) 题型:填空题
(1)已知下列两个热化学方程式:
C3H8(g)+5O2(g) 3CO2(g)+4H2O(l) ΔH=-2220.0 kJ·mol-1
H2O(l) H2O(g) ΔH=+44.0 kJ·mol-1
则0.5 mol丙烷燃烧生成CO2和气态水时释放的热量为 。
(2)已知:TiO2(s)+2Cl2(g) TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g) 2CO(g) ΔH=-221 kJ·mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:
(3)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如右图所示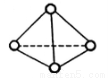 ),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN
),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________kJ能量。
(4)阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:
2H2+O2 2H2O,电解质溶液为稀H2SO4溶液,电池放电时是将___________能转化为__________能。其电极反应式分别为:负极_________________,正极____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com