
| ||
| ||
| ||
| ||
| 3.36L |
| 22.4L/mol |
| 4.48L-33.6L |
| 22.4L/mol |
| 4.48L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将盐酸滴入碳酸钠溶液中 | 有气泡产生 | 氯的非金属性比碳强 |
| B | 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 | 生成白色沉淀 | 溶液X中一定含有CO32-或HCO3- |
| C | 向淀粉溶液加入稀H2SO4,加热几分钟,冷却后再加入 新制Cu(OH)2,加热 | 没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| D | 取久置的绿矾(FeSO4?7H2O)溶于水,加入KSCN溶液 | 溶液变为血红色 | 绿矾部分或全部被氧化 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

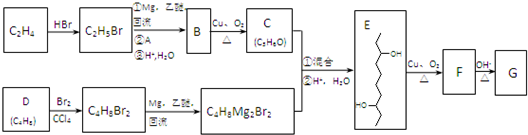
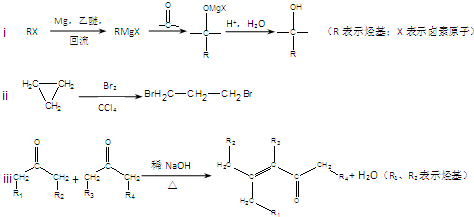
 )是合成APM的原料之一.APM的结构简式如图1所示.
)是合成APM的原料之一.APM的结构简式如图1所示.
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,则一定有CO32- |
| B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则一定有SO42- |
| C、分别含有Mg2+、Cu2+和Na+的三种盐酸盐溶液,用NaOH溶液就能一次鉴别开 |
| D、加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1:1 |
| B、6:3:2 |
| C、3:2:1 |
| D、1:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 足量的石灰浆 |
| 操作① |
| 适量盐酸 |
| 操作② |
| HCl气流 |
| 操作③ |
| 电解 |
| 操作④ |
| A、操作①发生的反应为非氧化还原反应 |
| B、若在实验室进行操作①只需要漏斗和烧杯两种玻璃仪器 |
| C、操作②是蒸发浓缩、冷却结晶 |
| D、在整个制备过程中,未发生置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaCl2有两性 |
| B、两支试管的白色沉淀均是亚硫酸钡 |
| C、SO2有还原性和酸性氧化物的通性 |
| D、以上说法均不合理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、S(g)+O2(g)=SO2(g)△H<-297.16 kJ/mol |
B、 单斜硫转变为正交硫的能量变化可用图表示 |
| C、常温下正交硫比单斜硫稳定 |
| D、单斜硫转化为正交硫的反应是放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com