
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO。制备流程图如下:
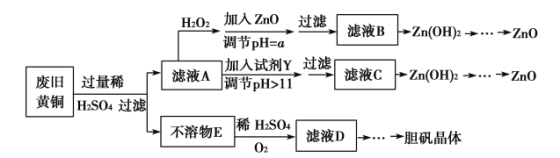
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
Fe3+ | Fe2+ | Zn2+ | |
开始沉淀的pH | 1.1 | 5.8 | 5.9 |
沉淀完全的pH | 3.0 | 8.8 | 8.9 |
请回答下列问题:
(1)加入ZnO调节pH=a的目的是______________________,a的范围________________________。
(2)由不溶物E生成溶液D的化学方程式为____________________________。
(3)滤液A中加入H2O2反应的离子方程式为________________________________________。
(4)由溶液D制胆矾晶体包含的主要操作步骤是__________________________
(5)下列试剂可作为Y试剂的是____________。
A.ZnO B.NaOH C.Na2CO3 D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是______________________。
【答案】(1)使溶液中的Fe3+完全沉淀,Zn2+不被沉淀(其他解释合理即可) 3.0≤a<5.9
(2)2Cu+O2+2H2SO4===2CuSO4+2H2O
(3)2Fe2++H2O2+2H+===2Fe3++2H2O
(4)蒸发浓缩、冷却结晶、过滤
(5)B 先产生白色沉淀后沉淀溶解
【解析】(1)加入ZnO调节pH=a的目的是使溶液中的Fe3+完全沉淀,Zn2+不被沉淀,a范围的选择是3.0≤a<5.9。
(2)由不溶物E生成溶液D的化学方程式为2Cu+O2+2H2SO4===2CuSO4+2H2O。
(3)滤液A中含有亚铁离子,加入H2O2反应的离子方程式为2Fe2++H2O2+2H+===2Fe3++2H2O。
(4)由硫酸铜溶液制胆矾晶体包含的主要操作步骤是蒸发浓缩、冷却结晶、过滤。
(5)因为pH>11,Y试剂的目的是让Zn(OH)2全部生成[Zn(OH)4]2-,所以Y试剂选用NaOH,滤液C的主要成分是[Zn(OH)4]2-,逐滴加入盐酸直到过量,跟AlO![]() 溶液中逐滴加入盐酸直到过量进行类推,所以产生的现象是先产生白色沉淀后溶解。
溶液中逐滴加入盐酸直到过量进行类推,所以产生的现象是先产生白色沉淀后溶解。


科目:高中化学 来源: 题型:
【题目】工业以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:
NH3+CO2+H2O===NH4HCO3
NH4HCO3+NaCl===NaHCO3↓+NH4Cl
2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是__________(填字母标号)。
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
d.碳酸氢钠的稳定性大于碳酸钠
(2)某活动小组根据上述制碱原理,进行碳酸氢钠的制备实验。
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。


试回答下列有关问题:
(Ⅰ)乙装置中的试剂是____________,其作用是____________________________;
(Ⅱ)丁装置中稀硫酸的作用是_______________________;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是__________(填分离操作的名称),该操作所需要的玻璃仪器有__________________________。
②另一位同学用图中戊装置(其他装置未画出)进行实验。
(Ⅰ)实验时,须先从a管通入________气体,说明原因:______________________;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是____________________。
(3)碳酸氢钠受热所得固体12.28 g与足量的石灰水充分反应,所得沉淀经洗涤、干燥质量为12.00 g,则所得固体中碳酸钠的质量分数为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在科学史上每一次重大的发现都极大地推进了科学的发展。下列对化学史的描述正确的是
A. 侯德榜制的碱是NaOH B. 卢瑟福提出原子有核模型
C. 道尔顿发现电子 D. 凯库勒的贡献在于确定了苯的分子式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,分类完全正确的一组是( )
A酸 | B碱 | C盐 | D氧化物 |
H2SO4 | Ba(OH)2 | H2S | H2O2 |
NaHCO3 | Cu2(OH)2CO3 | KCl | CO |
HNO3 | NaOH | CaCO3 | CuO |
HCl | Na2CO3 | CuSO4 | MnO2 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质的判断中,正确的观点是( )
A.在熔融状态下能导电的物质
B.在熔融或溶解状态下能导电的物质
C.在溶解或熔融状态下能导电的化合物
D.在熔融和溶液的状态下都能导电的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用 Y 型管与其它仪器组合可以进行许多实验(固定装置略)。分析并回答下列问题:
(1) |
| 实验目的:验证SO2有氧化性 将胶头滴管中浓硫酸分别滴入Y型管的两个支管中,在支管交叉处实验现象为_____________; 硫化亚铁处加水的目的是_________________。 |
(2) |
| 实验目的:探究SO2与BaCl2反应产生沉淀的条件 二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则右侧Y型管中应放置的药品是______(必要时可以加热),该沉淀的化学式为_______________。 |
(4) |
| 实验目的:锌铁合金中铁含量的测定 ①读取量气管中数据时,若发现水准管中的液面低于量气管中液面,应采取的措施是___________; ②若称得锌铁合金的质量为0.117g,量气管中初读数为1.00mL,末读数为45.80mL,则合金中铁的含量为_______%(保留2位小数,已折算标况)。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前世界上60%的镁单质是从海水中提取的,已知海水提镁的主要步骤如图:

(1)为了使MgSO4转化为Mg(OH)2,试剂①可选用_______。试剂②可选用_______。
(2)本生产流程主要牵涉三个化学反应:写出前两个式子
A.海水→沉淀:__________________(离子方程式)
B.沉淀→溶液:__________________(离子方程式)
C.MgCl2→Mg:
(3)海水中提镁中如何实现对镁离子的富集_______(填代号).
A.直接往海水中加入沉淀剂
B.高温加热蒸发海水后,再加入沉淀剂
C.利用晒盐后的苦卤水,再加入沉淀剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.20g Cu跟50.0mL l0.0mol/L的HNO3充分反应,还原产物有NO和NO2,若反应后溶液中有xmolH+,则此时溶液中合NO3-的物质的量为( )
A. xmol B. (x+0.1) mol C. 2xmol D. 0.1xmol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的数值,则下列说法正确的是( )
A.1.8 g D2O含有NA个中子
B.用5 mL 3 mol/L FeCl3溶液制成的氢氧化铁胶体中所含胶粒数为0.015NA
C.在Na2O2与CO2的反应中,每转移NA个电子时,消耗22.4 L的CO2
D.25 ℃时,7 g C2H4和C3H6的混合气体中,含有NA个C—H键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com