
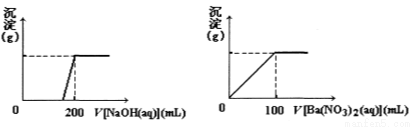
»ئح؟َµؤض÷زھ³ة·ضXتاسةCu،¢Fe،¢Sبضضشھثط×é³ةµؤ¸´رخ£¬ئنضذCu،¢Feء½ضضشھثطµؤضتء؟±بخھ8:7£»½«m g X·غؤ©ب«²؟بـسع200 mLµؤإ¨HNO3£¬·´س¦؛َµؤبـز؛¼سث®د،تحضء2£®12 Lت±²âµأئنpHخھ0£»½«د،تح؛َµؤبـز؛·ضخھء½µب·ف£¬دٍئنضذز»·فبـز؛ضذµخ¼س6£®05 mol/LµؤNaOHبـز؛£¬دٍءيز»·فبـز؛ضذµخ¼س0£®600 mol/L Ba(NO3)2بـز؛£¬ء½بـز؛ضذ¾ùةْ³ة³ءµي£¬از³ءµيµؤضتء؟ثوثù¼سبـز؛µؤجه»±ن»¯بçدآح¼ثùت¾£؛
£¨1£©اëح¨¹¼ئثمب·¶¨mµؤضµ£»
£¨2£©Xµؤؤ¦¶ûضتء؟خھ368 g/mol£¬اëب·¶¨Xµؤ»¯ر§ت½،£
£¨1£©،¾½âخِ،؟
زہجâز⣬m g Xضذ£؛n(Cu):n(Fe)£½1:1
2n(Cu2£«)£«3n(Fe3£«)£½6£®05mol/L،ء0£®2 L،ء2?1 mol/L،ء2£®12 L
¹ت£؛n(Cu)£½n(Fe)£½0£®06 mol £¨2·ض£©
سض£¬n(S)£½0£®6 mol/L،ء0£®1 L،ء2£½0£®12 mol
زٍ´ث£¬mg£½m(Cu)£«m(Fe)£«m(S)£½0£®06 mol،ء64 g/mol£«0£®06 mol،ء56 g/mol£«0£®12 mol،ء32 g/mol£½ 11£®04 g
¼´mµؤضµخھ11£®04£¨2·ض£©
£¨2£©½â£؛ةèXµؤ»¯ر§ت½خھ(CuFeS2)n£¬شٍ£؛(64£«56£«32،ء2)،ءn£½368 n£½2£¬¹تXµؤ»¯ر§ت½خھCu2Fe2S4 £¨2·ض£©
،¾½âخِ،؟
تشجâ·ضخِ£؛£¨1£©زہجâز⣬Cu،¢Feء½ضضشھثطµؤضتء؟±بخھ8£؛7£¬شٍm g Xضذ£؛n£¨Cu£©£؛n£¨Fe£©=8/64£؛7/56=1£؛1£¬µ±¼سث®د،تحضء 2£®12 Lت±²âµأئنpHخھ0£¬´ثتااâہë×سإ¨¶بخھ1mol/L£¬¸ù¾فح¼ت¾ت¾ف£¬اâرُ»¯ؤئدبضذ؛حاâہë×س£¬ب»؛َ½«½ًتôہë×س×ھ»¯خھ³ءµي£¬ثùزش2n£¨Cu2+£©+3n£¨Fe3+£©=6£®05mol?L-1،ء0£®2L،ء2-1mol?L-1،ء2£®12L£¬
¹ت£؛n£¨Cu£©=n£¨Fe£©=0£®06mol£¬n£¨S£©=0£®600mol?L-1،ء0£®1L،ء2=0£®12mol£¬
زٍ´ثmg=m£¨Cu£©+m£¨Fe£©+m£¨S£©=0£®06mol،ء64g?mol-1+0£®06mol،ء56g?mol-1+0£®12mol،ء32g?mol-1=11£®04g£¬¼´mµؤضµخھ11£®04£®
£¨2£©،¾½âخِ،؟
ةèXµؤ»¯ر§ت½خھ£¨CuFeS2£©n£¬شٍ£¨64+56+32،ء2£©،ءn=368£¬½âµأ£؛n=2£¬¹تXµؤ»¯ر§ت½خھCu2Fe2S4£®
؟¼µم£؛½ل؛دح¼دَضھت¶؟¼²éر§ةْب·¶¨¸´شس»¯ر§ت½µؤ¼ئثم·½·¨،£



| ؤ꼶 | ¸كضذ؟خ³ج | ؤ꼶 | ³ُضذ؟خ³ج |
| ¸كز» | ¸كز»أâ·ر؟خ³جحئ¼ِ£، | ³ُز» | ³ُز»أâ·ر؟خ³جحئ¼ِ£، |
| ¸ك¶ | ¸ك¶أâ·ر؟خ³جحئ¼ِ£، | ³ُ¶ | ³ُ¶أâ·ر؟خ³جحئ¼ِ£، |
| ¸كب | ¸كبأâ·ر؟خ³جحئ¼ِ£، | ³ُب | ³ُبأâ·ر؟خ³جحئ¼ِ£، |
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛2016½ىصم½ت،¸كز»ةدر§ئعئعضذ؟¼تش»¯ر§تش¾ي£¨½âخِ°و£© جâذح£؛ر،شٌجâ
بثأا¶شش×س½ل¹¹µؤبدت¶سذز»¸ِ²»¶دةîبëµؤ¹³ج£¬دآءذدب؛َث³ذٍضذ·û؛دت·تµµؤتا£¨ £©
¢ظµہ¶û¶ظجل³ِµؤش×سآغ
¢عآ¬ةھ¸£µؤش×س½ل¹¹ذذذاؤ£ذح
¢غ²¨¶ûجل³ِµؤش×سء¦ر§ؤ£ذح
¢ـجہؤ·ةْجل³ِµؤئدجر¸ةأو°üش×سؤ£ذح
A£®¢ظ¢ـ¢ع¢غ B£®¢ظ¢ع¢ـ¢غ C£®¢ع¢ظ¢ـ¢غ D£®¢ظ¢غ¢ع¢ـ
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛2016½ىصم½ت،؛ضفتذ¸كز»ةدر§ئعئعؤ©؟¼تش»¯ر§تش¾ي£¨½âخِ°و£© جâذح£؛ر،شٌجâ
دآءذذًتِ²»صب·µؤتا
A£®·ضة¢ضتء£×سض±¾¶شع10-9m ،«10-7mض®¼نµؤ·ضة¢دµ½ذ×ِ½؛جه
B£®ةظء؟½ًتôؤئ؟ة±£´وشعأ؛سحضذ
C£®×îحâ²مµç×ستدàح¬µؤش×س¾كسذدàثئµؤ»¯ر§ذشضت
D£®جہؤ·ةْ،¢آ¬ةھ¸£،¢²£¶ûµب؟ئر§¼ز¶شش×س½ل¹¹ؤ£ذحµؤجل³ِ×÷³ِءث؛ـ´َ¹±د×
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛2016½ىصم½ت،؛ضفتذتô¾إذ£¸كز»12شآءھ؟¼»¯ر§تش¾ي£¨½âخِ°و£© جâذح£؛ر،شٌجâ
دآءذتش¼ءµؤ±£´و»ٍت¹سأصب·µؤتا£¨ £©
A£®تµرéتزµؤآبث®ذèزھ±£´وشع×طة«تش¼ءئ؟ضذ
B£®ئ¯°×·غ±بآبث®خب¶¨£¬؟ةآ¶ضأشع؟صئّضذ
C£®³ئء؟اâرُ»¯ؤئ¹ججهت±£¬؟ةشعجىئ½ء½¸ِحذإجةد¸÷·إز»صإµبضتء؟µؤض½£¬×َ±كض½ةد·إNaOH£¬سز±كض½ةد·إ يہآë
D£®½ًتôؤئ؟ة±£´وشعأ؛سح،¢ثؤآب»¯ج¼µبسذ»ْبـ¼ءضذ
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛2016½ىصم½ت،؛ضفتذتô¾إذ£¸كز»12شآءھ؟¼»¯ر§تش¾ي£¨½âخِ°و£© جâذح£؛ر،شٌجâ
ةèNAخھ°¢·üظ¤µآآق³£تµؤضµ،£دآءذثµ·¨صب·µؤتا£¨ £©
A£®±ê×¼×´؟ِدآ£¬0£®1molCl2بـسعث®£¬×ھزئµؤµç×ستؤ؟خھ0£®1NA
B£®³£خآ³£ر¹دآ£¬16gO2؛حO3µؤ»ى؛دئّجهضذ؛¬سذµؤش×س×ـتخھNA
C£®±ê×¼×´؟ِدآ£¬11.2LH2Oضذ؛¬سذ·ض×سµؤتؤ؟خھ0.5NA
D£®2.4g½ًتôأ¾±ن³ةأ¾ہë×ست±ت§ب¥µؤµç×ستؤ؟خھ0.1NA
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛2016½ىصم½ت،؛¼ضفتذ¸كز»ةدر§ئعئعؤ©ؤ£ؤâ؟¼تش»¯ر§تش¾ي£¨½âخِ°و£© جâذح£؛جî؟صجâ
¶رُ»¯آب£¨ClO2£©تاز»ضضشعث®´¦ہيµب·½أوسذ¹م·؛س¦سأµؤ¸كذ§°²ب«دû¶¾¼ء،£ClO2تاز»ضض»ئآجة«µؤئّجه£¬ز×بـسعث®،£تµرéتززشNH4C1،¢رخثل،¢NaClO2£¨راآبثلؤئ£©خھشءدضئ±¸ClO2µؤء÷³جبçدآ£؛
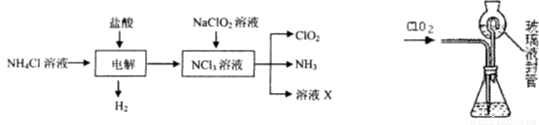
¢إ ذ´³ِµç½âت±·¢ةْ·´س¦µؤ»¯ر§·½ت½£؛ ،£
¢ئ ²â¶¨ClO2£¨بçسزح¼£©µؤ¹³جبçدآ£؛شع׶ذخئ؟ضذ¼سبë×م×îµؤµâ»¯¼ط£¬سأ100 mLث®بـ½â؛َ£¬شظ¼س3 mLءٍثلبـز؛£»شع²£ء§ز؛·â¹ـضذ¼سبëث®£»½«ةْ³ةµؤClO2ئّجهح¨¹µ¼¹ـشع׶ذخئ؟ضذ±»خüتص£»½«²£ء§·â¹ـضذµؤث®·âز؛µ¹بë׶ذخئ؟ضذ£¬¼سب뼸µخµي·غبـز؛£¬سأc mol/Lءٍ´ْءٍثلؤئ±ê×¼بـز؛µخ¶¨£¨I2£«2S2O32££½2I££«S4O62£)£¬¹²سأب¥V mLءٍ´ْءٍثلؤئبـز؛،£
¢ظ ClO2ح¨بë׶ذخئ؟سëثلذشµâ»¯¼طبـز؛·´س¦£¬·´س¦µؤہë×س·½³جت½خھ£؛ ،£
¢ع ×°ضأضذ²£ء§ز؛·â¹ـµؤ×÷سأتا ،¢ ،£
¢غ µخ¶¨ضءضصµمµؤدضدَتا ،£
¢ـ ²âµأClO2µؤضتء؟m(ClO2)£½ ،££¨سأ؛¬c،¢Vµؤ´ْتت½±يت¾£©
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛2016½ىصم½ت،؛¼ضفتذ¸كز»ةدر§ئعئعؤ©ؤ£ؤâ؟¼تش»¯ر§تش¾ي£¨½âخِ°و£© جâذح£؛ر،شٌجâ
دآءذثµ·¨ضذصب·µؤتا£¨ £©
A£®±ê×¼×´؟ِدآ£¬22£®4Lث®ضذثù؛¬µؤ·ض×ستش¼خھ6£®02،ء1023¸ِ
B£®1 mol Cl2²خ¼س·´س¦×ھزئµç×ستز»¶¨خھ2 NA
C£®±ê×¼×´؟ِدآ£¬aLرُئّ؛حµھئّµؤ»ى؛دخï؛¬سذµؤ·ض×ستش¼خھ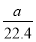 ،ء6£®02،ء1023¸ِ
،ء6£®02،ء1023¸ِ
D£®´س1 L 0£®5 mol/LNaClبـز؛ضذب،³ِ100 mL,£¬ت£سàبـز؛ضذNaClخïضتµؤء؟إ¨¶بخھ0£®45mol/L
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛2016½ىصم½ت،¸كز»دآر§ئعئعضذ؟¼تش»¯ر§تش¾ي£¨½âخِ°و£© جâذح£؛ر،شٌجâ
»¯ر§·´س¦N2£«3H2  2NH3µؤؤـء؟±ن»¯بçدآح¼ثùت¾£¬¸أ·´س¦µؤبب»¯ر§·½³جت½تا£¨ £©
2NH3µؤؤـء؟±ن»¯بçدآح¼ثùت¾£¬¸أ·´س¦µؤبب»¯ر§·½³جت½تا£¨ £©
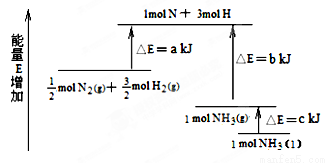
A£®N2(g)£«3H2(g)  2NH3(l) ¨SH £½2(a،ھb،ھc)kJ،¤mol£1
2NH3(l) ¨SH £½2(a،ھb،ھc)kJ،¤mol£1
B£®N2(g)£«3H2(g)  2NH3(g) ¨SH £½2(b،ھa)kJ،¤mol£1
2NH3(g) ¨SH £½2(b،ھa)kJ،¤mol£1
C£®1/2N2(g)£«3/2H2(g)  NH3(l) ¨SH £½ (b£«c،ھa)kJ،¤mol£1
NH3(l) ¨SH £½ (b£«c،ھa)kJ،¤mol£1
D£®1/2N2(g)£«3/2H2(g)  NH3(g) ¨SH £½ (a£«b)kJ،¤mol£1
NH3(g) ¨SH £½ (a£«b)kJ،¤mol£1
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛2016½ىصم½ت،ؤ²¨تذ¸كز»ةدر§ئعئعؤ©؟¼تش»¯ر§تش¾ي£¨½âخِ°و£© جâذح£؛ر،شٌجâ
دآءذذًتِصب·µؤتا
A£®1 mol H2Oµؤضتء؟خھ18g،¤mol-1
B£®ضتء؟تخھ37µؤآبش×س 17 37Cl
C£®3.01،ء1023¸ِSO2·ض×سµؤضتء؟خھ32g
D£®±ê×¼×´؟ِدآ,1 molبخ؛خخïضتجه»¾ùخھ22.4L
²é؟´´ً°¸؛ح½âخِ>>
°ظ¶بضآذإ - ء·د°²لءذ±ي - تشجâءذ±ي
؛±±ت،»¥ءھحّخ¥·¨؛ح²»ء¼ذإد¢¾ظ±¨ئ½ج¨ | حّةدسذ؛¦ذإد¢¾ظ±¨×¨اّ | µçذإص©ئ¾ظ±¨×¨اّ | ةوہْت·ذéخقض÷زهسذ؛¦ذإد¢¾ظ±¨×¨اّ | ةوئَاضب¨¾ظ±¨×¨اّ
خ¥·¨؛ح²»ء¼ذإد¢¾ظ±¨µç»°£؛027-86699610 ¾ظ±¨ستدن£؛58377363@163.com