
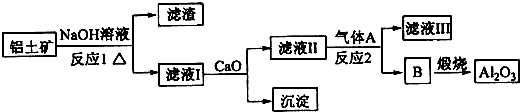
分析 铝土矿的主要成分是Al2O3和SiO2等,与NaOH反应生成NaAlO2、Na2SiO3,反应1的滤液中含有NaAlO2和Na2SiO3加入CaO,Na2SiO3变为CaSiO3沉淀,故滤液Ⅱ中的溶质为NaAlO2,通入A生成B,B煅烧生成Al2O3,故B为Al(OH)3,气体A应该为CO2,B为Al(OH)3,以此解答该题.
解答 解:铝土矿的主要成分是Al2O3和SiO2等,与NaOH反应生成NaAlO2、Na2SiO3,反应1的滤液中含有NaAlO2和Na2SiO3加入CaO,Na2SiO3变为CaSiO3沉淀,故滤液Ⅱ中的溶质为NaAlO2,通入A生成B,B煅烧生成Al2O3,故B为Al(OH)3,气体A应该为CO2,B为Al(OH)3,
(1)铝土矿的主要成分是Al2O3和SiO2等,与NaOH反应:Al2O3+2NaOH=2NaAlO2+H2O;SiO2+2NaOH=Na2SiO3+H2O,氧化铁与氢氧化钠不反应,则滤渣1为Fe2O3,
故答案为:2NaOH+SiO2=Na2SiO3+H2O;2NaOH+Al2O3=2NaAlO2+H2O;Fe2O3;
(2)滤液Ⅰ中含有硅酸钠、偏铝酸钠,加入CaO,生成氢氧化钙,氢氧化钙与硅酸钠反应生成CaSiO3沉淀;
由工艺流程可知,B为氢氧化铝,故气体A为二氧化碳,滤液Ⅱ主要是偏铝酸钠,偏铝酸钠溶液通入二氧化碳,生成氢氧化铝与碳酸氢钠,反应方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:CaSiO3;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)工业用电解氧化铝的方法冶炼铝,电解制铝的化学方程式是2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,以石墨为电极,阳极产生阳极生成氧气,部分氧气可以石墨反应生成二氧化碳、CO,故阳极气体有O2、CO2(或CO).
故答案为:2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑; O2、CO2(CO).
点评 本题考查化学工艺流程、无机物推断、电解原理等,为高考常见题型,题目难度中等,理解工艺流程是解题的关键,需要学生基本扎实的据此与运用知识分析解决问题的能力.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯水加入溴化钠溶液中 | B. | 溴水加入氟化钠溶液中 | ||
| C. | 氯水加入碘化钾溶液中 | D. | 溴水加入碘化钾溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘 | |
| B. | 当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据 | |
| C. | 制备硫酸亚铁铵晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液表面出现晶膜为止,不能将溶液全部蒸干 | |
| D. | 向盛l mL lmol•L-1AlCl3溶液的试管中加入3 mL10%NaF溶液,再加入l mL 3mol•L-1氨水,没有生成白色沉淀,其最主要的原因是氨水的浓度不够大,溶液的碱性不够 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的分子模型示意图: | |
| B. | 硫原子的轨道表示式为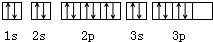 | |
| C. | 硫离子的核外电子排布式 1s22s22p63s23p4 | |
| D. | 碳-12原子构成 ${\;}_{6}^{12}$C |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com