
【题目】砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长。
(1)已知H3AsO3是两性偏酸性的化合物,H3AsO3中As的化合价为_____,它与足量硫酸反应时生成盐的化学式为_______________。Na2HAsO3溶液呈碱性,原因是_________________(用离子方程式表示),该溶液中c(H2AsO3-) _____c(AsO33-)(填”>”、“<”或“=”)。
(2)砷在自然界中主要以硫化物形式(如雄黄As4S4、雌黄As2S3等)存在。
①工业上以雄黄为原料制备砷、鉴定砒霜(As2O3)的原理如下图:

反应a产生的废气直接排放可能带来的环境问题是_______________,请写出反应b的化学方程式:_________________________。
②雌黄可被浓硝酸氧化为H3AsO4与S,硝酸被还原为NO2,反应中还原剂与氧化剂物质的量之比为_________。
③向c(As3+)=0.01mol/L的工业废水中加入FeS固体至砷完恰好完全除去(小于1×10-5mol/L),则此时c(Fe2+)=_____mol/L。(已知Ksp(As2S3)=1×10-22,Ksp(FeS)=6×10-18)
(3)某原电池装置如右图,电池总反应为AsO43-+2I-+H2O![]() AsO33-+I2+2OH-。
AsO33-+I2+2OH-。

当P池中溶液由无色变成蓝色时,正极上的电极反应式为_______________。当电流计指针归中后向Q池中加入一定量的NaOH,则电子由_____(填“P”或“Q”)池流出。
【答案】(1)+3;As2(SO4)3;HAsO32-+H2O ![]() H2AsO3-+OH-;>
H2AsO3-+OH-;>
(2)① 造成硫酸型酸雨;As2O3+6Zn+6H2SO4= 2AsH3 ↑+ 6ZnSO4+ 3H2O;②1:10;③6×10-14
(3)AsO43-+H2O+2e-= AsO33-+2OH-;Q
【解析】
试题分析:(1)根据正负化合价的代数和为0,H3AsO3中As的化合价为+3价,已知H3AsO3是两性偏酸性的化合物,它与足量硫酸反应时生成盐为As2(SO4)3;Na2HAsO3溶液呈碱性,原因是Na2HAsO3水解程度大于电离程度,故答案为:+3;As2(SO4)3;HAsO32-+H2O ![]() H2AsO3-+OH-;>;
H2AsO3-+OH-;>;
(2)①雄黄As4S4中的S元素在空气中煅烧生成As2O3和SO2,因此反应a产生的废气直接排放可能造成酸雨,反应b中As2O3和锌在硫酸存在的条件下反应生成了AsH3 ,反应的化学方程式为As2O3+6Zn+6H2SO4= 2AsH3 ↑+ 6ZnSO4+ 3H2O,故答案为:造成硫酸型酸雨;As2O3+6Zn+6H2SO4= 2AsH3 ↑+ 6ZnSO4+ 3H2O;
②雌黄(As2S3)可被浓硝酸氧化为H3AsO4与S,硝酸被还原为NO2,根据得失电子守恒,反应的方程式为As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,反应中还原剂与氧化剂物质的量之比为1:10,故答案为:1:10;
③向c(As3+)=0.01mol/L的工业废水中加入FeS固体至砷完恰好完全除去(小于1×10-5mol/L),c(S2-)=![]() =
=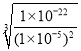 =1×10-4 mol/L,c(Fe2+)=
=1×10-4 mol/L,c(Fe2+)=![]() =
=![]() =6×10-14 mol/L,故答案为:6×10-14;
=6×10-14 mol/L,故答案为:6×10-14;
(3)当P池中溶液由无色变成蓝色时,反应正向进行,且P区发生碘离子的氧化反应,为负极,则正极上的电极反应式为AsO43-+H2O+2e-= AsO33-+2OH- ;当电流计指针归中后向Q池中加入一定量的NaOH,则反应逆向进行,Q池为负极,则电子由Q池流出,故答案为:AsO43-+H2O+2e-= AsO33-+2OH-;Q。


科目:高中化学 来源: 题型:
【题目】下列各组表述中,两个微粒一定不属于同种元素原子的是( )
A. 3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子
B. M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子
C. 最外层电子数是核外电子总数的1/5的原子和价电子排布为4s24p5的原子
D. 2p能级有一个未成对电子的基态原子和原子的价电子排布为2s22p5的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、按盐和纯碱等的原料。
(1)以氨为燃料,氧气为氧化剂可以设计制造氨燃料电池,因产物无污染,在很多领域得到广泛应用。若电极材料均为惰性电极,KOH 溶液作电解质溶液,则该电池负极电极反应式为_______________;正极反应式为______________。
(2)下列措施可以加快合成氨反应速率的是______________。
A.通过缩小容器的容积增大压强 B.及时将氨液化分离出去
C.适当升温 D.添加合适的催化剂
E.恒温恒容时,再充入一定体积的氮气
(3)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入lmolN2 和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则①从反应开始到25min时,以N2表示的平均反应速率为________;
②H2的平衡转化率为_______________;
(4)以CO2与NH3为原料合成尿素[化学式为CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);△H=-159.47kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);△H=+116kJ·mol-1
③ H2O(l)=H2O(g);△H=+44kJ·mol-1
写出CO2 与NH3 合成尿素和液态水的热化学反应方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与人类生产、生活息息相关.回答下列问题:
(1)基态N原子中电子在2p轨道上的排布遵循的原则是__________,前4周期元素中,基态原子核外电子排布成单电子数最多的元素的价层电子排布式为__________。
(2)C、N、O三种元素第一电离能从大到小的顺序是__________。
(3)N2F2分子中N原子的杂化方式是__________,l mol N2F2含有__________molσ键.
(4)NF3的键角__________NH3的键角(填“<”“>”或“=”),原因是__________.
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一.l mol NH4BF4__________mol配位键.
(6)安全气囊的设计原理为6NaN3+FeIO3![]() Na2O+2Fe+9N2↑
Na2O+2Fe+9N2↑
①等电子体的原理是:原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,具有许多相近的性质.写出两种与N3-互为等电子体的分子或离子__________.
②Na2O的晶胞结构如图所示,品胞边长为566pm,晶胞中氧原子的配位数为__________,Na2O晶体的密度为__________gcm-3(只要求列算式,不必计算出结果)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其他五种元素都是短周期元素。X、Y、E三种元素组成的化合物是实验室常用燃料,也是一种家庭常见饮品的主要成分。取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体。G2E是红色固体。请回答下列问题:
(1)写出基态G原子电子排布式: ;Y、Z、E、F、G的第一电离能由小到大的顺序为 (用元素符号表示)。
(2)X、Y、Z形成3原子分子M,每个原子价层电子均达到稳定结构。M分子的结构式为 。1molM含![]() 键数目为 。
键数目为 。

(3)根据价层电子对互斥理论(VESPR)推测:ZE2—的立体构型为 ,YE32—的中心原子杂化类型为 。
(4)Y、E、Z分别与X形成的简单化合物沸点由高到底的顺序为 (用化学式表示) 。
(5)G晶胞结构如图所示。已知立方体的棱长为apm,G 晶体密度为bg·cm-3,则阿伏加德罗常数NA= (用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,完成下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________。请指出装置中的另外错误是 。
(2)烧杯间填满碎纸条的作用是___________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值___________(填“偏大”“偏小”“无影响”)。
(4)实验中改用60mL0.50mol·L-1的盐酸跟60mL0.55mol·L-1NaOH溶液进行上述实验相比,所放出的热量___________(填“相等”“不相等”),所求中和热___________(填“相等”“不相等”)。
(5)用相同浓度体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会_____;用50 mL 0.50 mol·L-1NaOH溶液进行上述实验,测得的中和热的数值会_____(均填“偏大”“偏小”“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A 不断溶解 | C的质 量增加 | A上有气 体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是____________________________________。
(2)装置乙中正极的电极反应式是_____________________________________,溶液中Cu2+向______极移动(填“B”或“C”)。
(3)当装置丙中产生3.36L(标准状况)气体时,电路中转移的电子数目为____________。
(4)四种金属活动性由强到弱的顺序是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是一种具有战略意义的金属,它具有多种价态,单质铬熔点为1857 ℃。
(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:
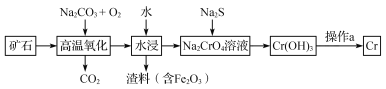
①Fe(CrO2)2中各元素化合价均为整数,则铬为_______价。
②高温氧化时反应的化学方程式为___________________________________。
③操作a由两种均发生了化学反应的过程构成的,其内容分别是_______________、铝热反应。
(2)Cr(OH)3是两性氢氧化物,请写出其分别与NaOH、稀硫酸反应时生成的两种盐的化学式____________________________。
(3)铬元素能形成含氧酸及含氧酸盐,若测得初始浓度为1 mol/L的铬酸 (H2CrO4) 溶液中各种含铬元素的微粒浓度分别为:c(![]() )=0.0005 mol·L1、c(
)=0.0005 mol·L1、c(![]() )=0.1035 mol·L1、c(
)=0.1035 mol·L1、c(![]() )=a mol·L1、则a=______,KHCrO4溶液中c(OH)___c(H+)(填“>”、“<”或“=”)。
)=a mol·L1、则a=______,KHCrO4溶液中c(OH)___c(H+)(填“>”、“<”或“=”)。
(4)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。
①处理含有![]() 的污水方法通常为:用铁作电极电解污水,
的污水方法通常为:用铁作电极电解污水,![]() 被阳极区生成的离子还原成为Cr3+,生成的Cr3+与阴极区生成的OH结合生成Cr(OH)3沉淀除去。则阴极上的电极反应式为_________________________,若要处理含10 mol
被阳极区生成的离子还原成为Cr3+,生成的Cr3+与阴极区生成的OH结合生成Cr(OH)3沉淀除去。则阴极上的电极反应式为_________________________,若要处理含10 mol ![]() 的污水,则至少需要消耗的铁为_______g。
的污水,则至少需要消耗的铁为_______g。
②转化为重要产品磁性铁铬氧体(CrxFeyOz):先向含![]() 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。写出
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。写出![]() 在酸性条件下被Fe2+还原为Cr3+ 的离子方程式:____________________________________,若处理含1 mol
在酸性条件下被Fe2+还原为Cr3+ 的离子方程式:____________________________________,若处理含1 mol![]() (不考虑其它含铬微粒) 的污水时恰好消耗10 mol FeSO4,则当铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2时,铁铬氧体的化学式为__________。
(不考虑其它含铬微粒) 的污水时恰好消耗10 mol FeSO4,则当铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2时,铁铬氧体的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化砜(SO2Cl2)是一种无色液体,主要用于有机物和无机物的氯化等。其熔点为-54.1℃.沸点为69.2℃;常温下比较稳定,受热易分解,遇水剧烈反应生成硫酸和盐酸。
(1)制备。实验室可利用SO2和Cl2按下列装置制取少量SO2Cl2(丙中放有樟脑液,起催化作用)。已知SO2(g)+Cl2(g)![]() SO2Cl2(g) △H<0
SO2Cl2(g) △H<0
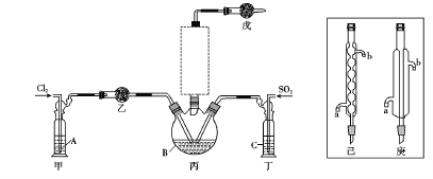
①可以用浓盐酸和酸性高锰酸钾制取氯气,该反应的化学方程式为 ;溶液A为 。
②上图实框中仪器己的名称为 ;反应装置图的虚框中未画出的仪器是 (填“己”或“庚”)。
③如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是 。
④下列有关说法错误的是 (填编号)。
a.乙、戊装置相同,在实验中的作用也完全相同
b.甲、丁装置为洗气装置,可用于气体的除杂和干燥
c.组装仪器后首先要进行的操作是检查装置的气密性
d.为提高反应物的利用率,可控制甲、丁装置中产生气泡的速率相等
(2)提纯。将收集到的产物进行减压蒸馏,减压蒸馏的目的是 。
(3)测定。取1.00g蒸馏后液体,小心地完全溶于水,向所得的溶液中加入足量氯化钡溶液,测得生成沉淀的质量为1.60g,则所得蒸馏成分中二氯化砜的质量百分含量为 %。
(4)贮存。二氯化砜应储存于阴凉、干燥、通风良好的库房。但久置后微显黄色,其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com