
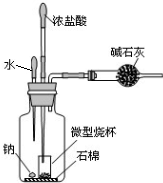


科目:高中化学 来源: 题型:
| A、生石膏(2CaSO4?H2O):用于制造各种模型 |
| B、纯碱(NaHCO3):用于制玻璃、肥皂、纺织 |
| C、硫酸钡(BaSO4):作白色颜料、“钡餐” |
| D、胆矾(CuSO4):用于制造农药 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯水通过SO2后溶液的酸性增强 |
| B、向明矾溶液中加入过量NaOH溶液会产生大量白色沉淀 |
| C、Na、Fe等金属在一定条件下与水反应都生成H2和对应的碱 |
| D、浓硫酸、浓硝酸在加热条件下能将木炭氧化为二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、②④⑤ |
| C、①③⑥ | D、①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
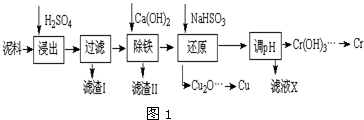
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com