
| A. | B与A只能组成BA3化合物 | |
| B. | 第三周期中,D原子的原子半径最大 | |
| C. | A、B、C三元素不可能形成离子化合物 | |
| D. | E的氧化物对应水化物一定有强的氧化性 |
分析 短周期中的A、B、C、D、E五种元素,原子序数依次增大,A为短周期元素中原子半径最小的元素,则A为H元素,A和D同主族,C2-与D+的核外电子数相等,结合所带电荷可知,C为O元素、D为Na;C和E同主族,则E为S元素;A与B的原子序数之和等于C的原子序数,则B的原子序数=8-1=7,故B为N元素,据此解答.
解答 解:短周期中的A、B、C、D、E五种元素,原子序数依次增大,A为短周期元素中原子半径最小的元素,则A为H元素,A和D同主族,C2-与D+的核外电子数相等,结合所带电荷可知,C为O元素、D为Na;C和E同主族,则E为S元素;A与B的原子序数之和等于C的原子序数,则B的原子序数=8-1=7,故B为N元素.
A.N元素与H元素能组成NH3、N2H4等化合物,故A错误;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,第三周期中,Na原子的原子半径最大,故B正确;
C.H、N、O三元素形成的硝酸铵属于离子化合物,故C错误;
D.E的氧化物对应水化物为硫酸、亚硫酸,浓硫酸具有强氧化性,但亚硫酸、稀硫酸没有强氧化性,故D错误,
故选:B.
点评 本题考查位置结构性质的关系及应用,难度中等,推断元素是解题的关键,A原子半径最小及C2-与D+的核外电子数相等是推断突破口.


科目:高中化学 来源: 题型:选择题
| A. | 平衡前,充入氮气,容器内压强增大,反应速率加快 | |
| B. | 平衡时,其他条件不变,分离出硫,逆反应速率减小 | |
| C. | 平衡时,其他条件不变,升高温度可提高 SO2 的转化率 | |
| D. | 其他条件不变,缩小容器体积,平衡正反应方向移动,该反应的平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m+n<p | B. | C气体的体积分数增大 | ||
| C. | 平衡向正反应方向移动 | D. | B的转化率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 结合Na、Al、Fe的有关性质,回答下列问题.
结合Na、Al、Fe的有关性质,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
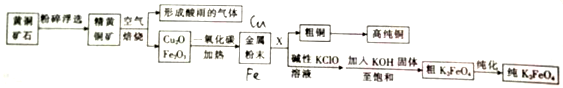
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu→CuSO4 | B. | C→CO2 | C. | CuO→CuSO4 | D. | Fe2O3→Fe2(SO4)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
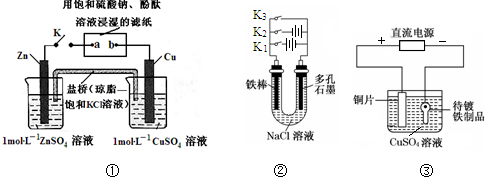
| A. | 装置①中K键闭合时,片刻后可观察到滤纸a点变红色 | |
| B. | 装置①中K键闭合时,片刻后CuSO4溶液中c(Cl-)增大 | |
| C. | 装置②中铁腐蚀的速度由大到小的顺序是:只闭合K1>只闭合K3>只闭合K2>都断开 | |
| D. | 装置③中当铁制品上析出1.6 g铜时,电源负极输出的电子数为0.025 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:W>X>Y>Z | B. | 原子半径:W>X>Y>Z | ||
| C. | W的最高价氢氧化物的碱性比X弱 | D. | Y的最简单氢化物的稳定性比Z的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生活中常用的塑料制品及橡胶制品都为高分子材料 | |
| B. | 向牛奶中加入果汁会产生沉淀,这是因为酸碱发生了中和反应 | |
| C. | 节日焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| D. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com