
| △c |
| △t |
| 消耗量 |
| 起始量 |
| c(ClNO) |
| c2(NO2) |
| c2(ClNO) |
| c2(NO)c(Cl2) |
| c(Cl2)c2(NO) |
| c4(NO2) |
| K12 |
| K2 |
| K12 |
| K2 |
| 0.15mol |
| 0.2mol |
| c(CO2) |
| c(CO) |
| 0.01 |
| x-0.01 |


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
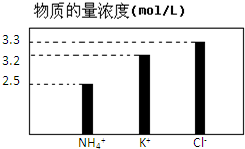 在无土栽培中,需配置20L含NH4Cl、KCl和K2CO3的营养液.营养液中部分离子的物质的量浓度如图所示.若用KCl、NH4Cl和(NH4)2CO3三种固体为原料来配制上述营养液,则需KCl、NH4Cl和(NH4)2CO3三种固体得物质的量依次为(单位为mol)( )
在无土栽培中,需配置20L含NH4Cl、KCl和K2CO3的营养液.营养液中部分离子的物质的量浓度如图所示.若用KCl、NH4Cl和(NH4)2CO3三种固体为原料来配制上述营养液,则需KCl、NH4Cl和(NH4)2CO3三种固体得物质的量依次为(单位为mol)( )| A、2、64、24 |
| B、16、50、24 |
| C、32、50、12 |
| D、64、2、24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霆形成的原因.
2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霆形成的原因.| 催化剂 |
| 实验组 | 温度 ℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:
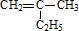 的键线式
的键线式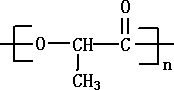 是由一种单体缩聚而成的,该单体的结构简式为
是由一种单体缩聚而成的,该单体的结构简式为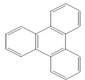 的一氯取代物有
的一氯取代物有查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 分子中含氧官能团的名称是
分子中含氧官能团的名称是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com