
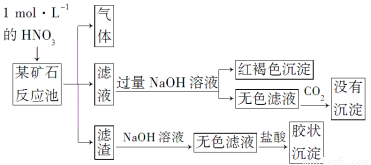
欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。
(1)Si在周期表中的位置是___________________________________。
(2)下列说法正确的是________。
a.酸性:H2CO3>H2SiO3
b.原子半径:O<C<Si<Al
c.稳定性:H2O>CH4>SiH4
d.离子半径:O2-<Al3+
(3)该矿石的组成是________,滤渣和NaOH溶液反应的离子方程式是_________________________________________________________。
(4)该矿石和1 mol·L-1HNO3反应的离子方程式为
___________________________________________________________。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中。目的是____________________________________;
若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1 mol·L-1 HNO3的体积为________L。
(1)第三周期第ⅣA族
(2)abc
(3)FeCO3和SiO2 SiO2+2OH-=SiO32—+H2O
(4)3FeCO3+10H++NO3—=3Fe3++3CO2↑+NO↑+5H2O
(5)NO循环使用能减少环境污染,NO跟H2O、O2反应后又得到硝酸提高原料利用率 3.3×104
【解析】 (3)与硝酸反应生成气体及与NaOH溶液反应生成红褐色沉淀,可知一定含有FeCO3,通入CO2反应无沉淀生成,可知矿石中无Al2O3;滤渣与NaOH反应后加入盐酸有胶状沉淀产生可知矿渣中含有SiO2。
(5)m(FeCO3)=2.36×106 g-1.2×106 g=1.16×106 g,n(FeCO3)=1×104 mol,依据方程式3FeCO3+10HNO3=3Fe(NO3)3+3CO2↑+NO↑+5H2O可知n(HNO3)=3.3×104 mol。


科目:高中化学 来源:2014年高考化学苏教版一轮复习1-1-2物质的分离和提纯练习卷(解析版) 题型:填空题
柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:
FeSO4+Na2CO3=FeCO3↓+Na2SO4
FeCO3+C6H8O7=FeC6H6O7+CO2↑+H2O
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
(1)制备FeCO3时,选用的加料方式是 (填字母),原因是 。
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是 。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80 ℃下搅拌反应。①铁粉的作用是 。
②反应结束后,无需过滤,除去过量铁粉的方法是 。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是 。
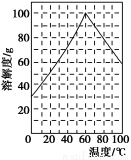
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁。请结合下图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应, ,得到FeSO4溶液, ,得到FeSO4·7H2O晶体。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学考前题型专练 保温训练(三)(解析版) 题型:选择题
下列说法正确的是( )。
A.打开盛浓盐酸的试剂瓶可看到白色的雾,这说明HCl不稳定
B.蔗糖中滴入浓硫酸,蔗糖变黑,这说明浓硫酸是氧化性酸
C.胆矾晶体中滴入浓硫酸,胆矾由蓝色变为白色,这说明浓硫酸有脱水性
D.碳酸、亚硫酸和次氯酸都是不稳定性酸
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第9练非金属及其化合物练习卷(解析版) 题型:填空题
NOx是汽车尾气中的主要污染物之一。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_____________。
(2)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:_______________________________________。
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是_______________,
元素的金属性逐渐增强,金属氧化物对NOx的吸收能力逐渐增强。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第9练非金属及其化合物练习卷(解析版) 题型:选择题
下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是( )
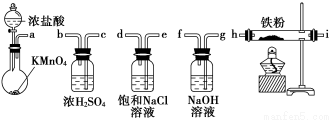
A.a-b-c-d-e-f-g-h
B.a-e-d-c-b-h-i-g
C.a-d-e-c-b-h-i-g
D.a-c-b-d-e-h-i-f
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第8练金属及其化合物练习卷(解析版) 题型:选择题
将15.6 g Na2O2和5.4 g Al同时放入一定量的水中,充分反应后得到200 mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72 L,若反应过程中溶液的体积保持不变,则下列说法正确的是( )
A.标准状况下,反应过程中得到7.84 L的气体
B.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
C.最终得到7.8 g的沉淀
D.最终得到的溶液中c(Na+)=1.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第7练电化学原理练习卷(解析版) 题型:填空题
人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图。
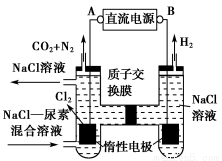
(1)电源的负极为________(填“A”或“B”)。
(2)阳极室中发生的反应依次为___________________________________、
___________________________________________________________。
(3)电解结束后,阴极室溶液的pH与电解前相比将________;若两极共收集到气体13.44 L(标准状况),则除去的尿素为________g(忽略气体的溶解)。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第6练水溶液中的离子平衡练习卷(解析版) 题型:选择题
某化学研究性学习小组对电解质溶液作如下的归纳总结:(均在常温下)
①常温下,pH=1的强酸溶液,加水稀释后,溶液中各离子的浓度一定降低
②pH=2的盐酸与pH=1的盐酸,c(H+)之比为2∶1
③25 ℃时,AgCl固体在等体积、等物质的量浓度的NaCl、CaCl2溶液中的溶解程度不同
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42—)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw,则三者关系为:Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液pH是乙溶液pH的两倍,则甲乙两溶液等体积混合,混合液pH可能等于7
其归纳正确的是( )
A.全部 B.③⑤⑥ C.④⑤⑥ D.①②④
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第3练化学反应与能量变化练习卷(解析版) 题型:选择题
如图所示,图像表示某一反应过程中的能量变化曲线。下列说法中不正确的是( )
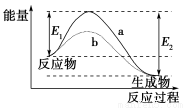
A.由图可知,该反应为放热反应
B.该反应的焓变为ΔH=-(E2-E1)
C.曲线b相对曲线a来说,改变的条件只能是使用了催化剂
D.该反应的发生条件一定是加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com