
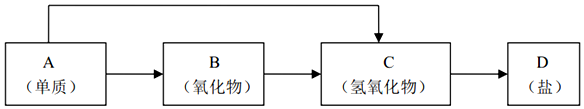
分析 金属单质可以形成氧化物,也可以直接生成氢氧化物碱、金属氧化物可以形成碱、金属氢氧化物一步形成盐,解题关键在金属单质可以直接形成碱的推断.A为活泼金属K、Ca、Na、Mg等;各步反应都需要一步形成,依据转化关系分析判断,
(1)A为钠与水反应生成氢氧化钠和氢气;
(2)若B为呼吸面具中的供养剂,其供养时每生成1mol O2,过氧化钠中氧元素化合价-1价变化为0价和-2价,1mol过氧化钠反应电子转移1mol;
(3)向固体Na2O2中通入11.6gCO2和H2O且完全反应,固体只增加3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8.0g,所以n(O2)=$\frac{8.0g}{32g/mol}$=0.25mol,根据反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑计算,则原混合物的平均相对分子质量=$\frac{气体总质量}{气体总物质的量}$;
(4)C→D转化的反应为氢氧化钠和盐酸反应生成氯化钠和水;
(5)小块金属钠露置于空气中发生的变化中,银白色$\stackrel{①}{→}$变灰暗$\stackrel{②}{→}$变白色$\stackrel{③}{→}$出现液滴$\stackrel{④}{→}$白色固体,①是钠被氧化为氧化钠;②是氧化钠和水反应生成氢氧化钠;③氢氧化钠潮解形成氢氧化钠溶液;④是二氧化碳和氢氧化钠反应生成碳酸钠固体.
解答 解:金属单质可以形成氧化物,也可以直接生成氢氧化物碱、金属氧化物可以形成碱、金属氢氧化物一步形成盐,解题关键在金属单质可以直接形成碱的推断.A为活泼金属K、Ca、Na、Mg等;各步反应都需要一步形成;
(1)A为钠,与水反应的化学方程式为:2Na+2H2O=2Na++2OH-+H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(2)若B为呼吸面具中的供氧剂,其供氧时主要反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2↑,其供氧时每生成1mol O2,反应过程中转移的电子数为2NA,
故答案为:2NA;
(3)由反应:2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,可知参加反应的CO2和H2O与生成O2的物质的量之比为2:1,m(增重)=m(吸收)-m(放出),即11.6g-m(O2)=3.6g,m(O2)=11.6g-3.6g=8.0g,
所以n(O2)=$\frac{8.0g}{32g/mol}$=0.25mol,n(CO2和H2O)=0.5mol,
则原混合气体的平均摩尔质量为$\frac{11.6g}{0.5mol}$=23.2g/mol,
原混合物的平均式量为23.2,
故答案为:23.2;
(4)C→D转化的化学方程式为:NaOH+HCl=NaCl+H2O,离子方程式为:OH-+H+=H2O,
故答案为:OH-+H+=H2O;
(5)Na的性质活泼,易与空气中氧气反应生成Na2O,Na2O易与水反应生成NaOH,NaOH吸收空气中的水和CO2生成Na2CO3•xH2O,Na2CO3•xH2O风化脱水生成Na2CO3,
A、①发生氧化还原反应生成了氧化钠,故A正确;
B、②变白色主要是因为生成了氢氧化钠,Na2O+H2O=2NaOH,故B错误;
C、③是氢氧化钠潮解,吸收水蒸气形成氢氧化钠溶液,故C错误;
D、④是二氧化碳和氢氧化钠反应生成碳酸钠固体,发生了化学反应,故D错误;
故答案为:A.
点评 本题考查了物质转化关系的分析判断,主要是转化关系的性质应用,主要考查金属及其化合物性质的应用,熟练掌握物质性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸中滴加碳酸氢钠溶液 | |
| B. | 硝酸溶液中滴加纯碱溶液 | |
| C. | 稀盐酸与石灰石反应 | |
| D. | 从草木灰中提取的碳酸钾与足量醋酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁易与非金属单质O2、Cl2等反应 | B. | 镁在空气中燃烧生成Mg2O和Mg2O2 | ||
| C. | 氢氧化镁是难溶于水的碱 | D. | 氧化镁熔点高,可以作耐高温材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含1个双键的环状有机物 | B. | 含2个双键的直链有机物 | ||
| C. | 只含有1个双键的直链有机物 | D. | 含一个三键的直链有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.9g水中含有的电子数为NA | |
| B. | 常温常压下,0.2 NA个NH3分子的质量为3.4g | |
| C. | 14.0g由C2H4和C3H6组成的混合气体原子总数为3NA | |
| D. | 1 mol Na变为Na+时失去的电子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,K值增大 | B. | K值越大,反应物转化率越大 | ||
| C. | 加入催化剂不改变平衡常数K | D. | 平衡向右移动K值不一定改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为0.1mol/L KMnO4标准溶液滴定.
为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为0.1mol/L KMnO4标准溶液滴定.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 30.32 | 25.34 | 25.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1 mol任何物质体积均为22.4L | |
| B. | CH4的摩尔质量为16g | |
| C. | 3.01×1023个SO2分子的质量为32g | |
| D. | 1 mol H2O的质量为18g/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com